题目内容
11.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
分析 (1)化学反应速率=$\frac{△V}{△t}$,因为时间相同,只要气体体积差大的反应速率就大;
(2)先计算氢气的物质的量再计算参加反应的HCl的物质的量,根据反应速率公式计算盐酸反应速率;
(3)为了减缓反应速率但不减少产生氢气的量,加入的物质应该降低氢离子浓度但不影响氢离子总物质的量.
解答 解:(1)化学反应速率=$\frac{△V}{△t}$,因为时间相同,只要气体体积差大的反应速率就大,0min~1min、1min~2min、2min~3min、3min~4min、4min~5min时间段中,△V分别为50mL、(120-50)mL=70mL、(232-120)mL=112mL、(290-232)mL=58mL、(310-290)mL=20mL,
所以反应速率最快的是2min~3min、最慢的是4~5 min,该反应是放热反应,升高温度反应速率增大,温度起主要影响作用,随着反应进行,氢离子浓度减小,反应速率减小,氢离子浓度起主要作用,
故答案为:2~3 min;该反应过程中放热使温度升高而加快反应速率,此时温度的影响起主要因素;4~5 min;该反应过程中消耗H+使C H+减小而减慢反应速率,此时C H+的影响起主要因素;
(2)在2min~3min时间段内,n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,参加反应的n(HCl)=2n(H2)=0.005mol×2=0.01mol,盐酸的反应速率=$\frac{\frac{0.01mol}{0.1L}}{1min}$=0.1 mol•L-1•min-1,
故答案为:0.1 mol•L-1•min-1;
(3)为了减缓反应速率但不减少产生氢气的量,加入的物质应该降低氢离子浓度但不影响氢离子总物质的量,
A.加入蒸馏水,氢离子浓度减小、氢离子总物质的量不变,所以符合条件,故正确;
B.加入Na2SO4溶液,氢离子浓度减小、氢离子总物质的量不变,所以符合条件,故正确;
C.加入NaNO3溶液,硝酸和锌反应生成氮的化合物而不是氢气,不符合条件,故错误;
D.加入Na2CO3溶液,盐酸和碳酸钠反应生成二氧化碳,导致和锌反应的氢离子总物质的量减少,不符合条件,故错误;
故选A、B.
点评 本题考查反应速率影响因素、反应速率的有关计算等知识点,侧重考查分析计算能力,注意反应速率公式的灵活运用,易错点是(3)C选项,硝酸和锌反应不生成氢气.

 阅读快车系列答案
阅读快车系列答案| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
| A. | 0.01% | B. | 0.1% | C. | 0.2% | D. | 1% |
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
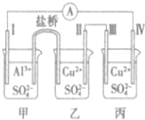 某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )
某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )| A. | 甲为原电池,乙、丙均为电解池 | |
| B. | 电子流动方向:电极Ⅳ→A→电极I | |
| C. | 当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g | |
| D. | 若丙中的电解质改为CuCl2,电极Ⅲ的电极反应发生改变 |
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
 .
. .
.