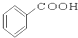
题目内容
15.(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
分析 (1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O;
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2.
解答 解:(1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水,装置排列顺序是气体制取装置、H2O检验装置、SO2检验装置、SO2吸收装置、SO2检验装置、CO2检验装置,所以排列顺序为:④→②→①→③,
故答案为:④;②;①;③;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,在排除SO2条件下将CO2通入澄清石灰水中检验CO2,所以①中A瓶现象是溶液褪色,证明产物中存在二氧化硫,B的作用是吸收SO2,发生反应为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:验证产物气流中有SO2;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,所以检验水可以用无水硫酸铜晶体,看到的现象是白色固体变为蓝色,
故答案为:无水硫酸铜;水;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2,所以③中所盛溶液澄清石灰水,验证的物质是CO2,现象为澄清石灰水变浑浊,
故答案为:澄清石灰水;变浑浊.
点评 本题以浓硫酸和碳的反应为载体考查性质实验方案设计,题目难度中等,明确二氧化硫和二氧化碳性质的相似性和差异性即可解答,注意在检验二氧化碳之前要将二氧化硫除尽,为易错点.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )| A. | 石墨Ⅱ电极为正极 | |
| B. | Y为N2O5 | |
| C. | 石墨Ⅰ电极方程式为NO+O2--2e-=NO2 | |
| D. | 不能用NaNO3水溶液代替熔融NaNO3 |
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:
仪器:①试管;②胶头滴管 (请填写两种主要玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下列空格内填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中, 振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫红色 |
(5)问题和讨论:
①请用物质结构理论简单说明得出上述结论的原因:同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱.试至少列举1个事实说明F的非金属性比Cl强:HF的稳定性强于HCl.
| A. | 其他条件不变时,升高温度,化学反应速率加快 | |
| B. | 其他条件不变时,增大浓度,化学反应速率加快 | |
| C. | 化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 | |
| D. | 化学反应的限度是不可以改变的 |
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
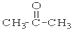 ③CH3CH2Br ④
③CH3CH2Br ④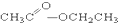 ⑤
⑤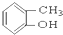 ⑥
⑥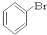 ⑦
⑦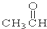 ⑧
⑧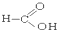 ⑨
⑨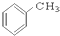 ⑩
⑩