题目内容
19.盐的水解程度大小可以用“水解度”来表示.关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数.若测得25℃时2L 0.1mol•L-1的强碱弱酸盐NaA溶液pH值为10,则A-的水解度是( )| A. | 0.01% | B. | 0.1% | C. | 0.2% | D. | 1% |
分析 强碱弱酸盐NaA溶液中存在A-+H2O?HA+OH-,溶液的pH为10,c(OH-)=10-4mol/L,已水解的盐的物质的量等于n(OH-),根据水解度的定义计算.
解答 解:n(NaA)=2L×0.1mol/L=0.2mol,强碱弱酸盐NaA溶液中存在A-+H2O?HA+OH-,溶液的pH为10,c(OH-)=10-4mol/L,则已水解的盐的物质的量等于为2L×10-4mol/L=2×10-4mol,
则A-离子的水解度为$\frac{2×1{0}^{-4}}{0.2}$×100%=0.1%,
故选B.
点评 本题考查盐类水解的原理和应用,侧重于信息给予的考查,题目难度不大,注意自学能力的培养,把握题给信息和要求.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有机物命名正确的是( )
| A. |  2-甲基-2-氯丙烷 | B. | 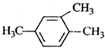 1,3,4-三甲苯 | C. | 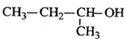 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 |
14.下列事实中,能说明氯的非金属性比溴强的是( )
| A. | HCl的酸性比HBr强 | |
| B. | 次氯酸的氧化性比次溴酸强 | |
| C. | 氯化氢比溴化氢的热稳定性好 | |
| D. | 氯原子最外层电子数比溴原子最外层电子数多 |
11.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
(1)在0min~1min、1min~2min、2min~3min、3min~4min、4min~5min时间段中,反应速率最大的时间段是2~3min,原因该反应过程中放热使温度升高而加快反应速率,此时温度的影响起主要因素;反应速率最小的时间段是4~5min,原因为该反应过程中消耗H+使C H+减小而减慢反应速率,此时C H+的影响起主要因素.
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
8.“钾泻盐”的化学式为MgSO4•KCl•xH2O,是一种制取钾肥的重要原料,它溶于水得到KCl与MgSO4的混合溶液.某化学活动小组设计了如下实验方案:以下说法不正确的是( )


| A. | 该方案能够计算出“钾泻盐”中KCl的质量分数 | |
| B. | 足量Ba(NO3)2溶液是为了与MgSO4充分反应 | |
| C. | “钾泻盐”化学式中x=3 | |
| D. | 上述实验数据的测定利用学校实验室里的托盘天平即可完成 |

 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +R3COOH
+R3COOH $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CH3COOH
+CH3COOH

 ;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.
;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化. B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应.
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应. .
. 硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.