题目内容
1.下列说法不正确的是( )| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
分析 A.硝酸根离子在酸性环境下具有强的氧化性,能够氧化铜;
B.湿润的红色石蕊试纸遇到碱变蓝;
C.铜与稀硝酸反应生成硝酸铜和一氧化氮和水;
D.稀硝酸与铜反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮.
解答 解:A.在稀硫酸中加入铜粉,再加入Cu(NO3)2固体,硝酸根离子在酸性环境下能够与铜反应生成硝酸铜,所以铜片溶解,故A错误;
B.某气体能使湿润的红色石蕊试纸变蓝,说明气体的水溶液一定呈碱性,故B正确;
C.铜与稀硝酸反应生成硝酸铜和一氧化氮和水,离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故C正确;
D.稀硝酸与铜反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,以上各步变化均能通过一步实现,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉硝酸的性质是解题关键,注意硝酸根离子在酸性环境下才能表现强的氧化性,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
12.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,下列叙述中正确的是( )
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 氮化铝中N的化合价为-3价 | |
| C. | 因为具有抗冲击、导热性好等优良性能,所以氮化铝属于金属材料 | |
| D. | 合成氮化铝的反应符合“绿色化学”的思想 |
16.下列性质不属于氨气的物理性质的是( )
| A. | 易液化 | B. | 极易溶于水 | C. | 水溶液显碱性 | D. | 有刺激性气味 |
13.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②可溶于水的盐都是强电解质
③0.5mol•L-1所有一元酸溶液中氢离子浓度都是0.5mol•L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电.
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②可溶于水的盐都是强电解质
③0.5mol•L-1所有一元酸溶液中氢离子浓度都是0.5mol•L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
11.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
(1)在0min~1min、1min~2min、2min~3min、3min~4min、4min~5min时间段中,反应速率最大的时间段是2~3min,原因该反应过程中放热使温度升高而加快反应速率,此时温度的影响起主要因素;反应速率最小的时间段是4~5min,原因为该反应过程中消耗H+使C H+减小而减慢反应速率,此时C H+的影响起主要因素.
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为0.1mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液 D.Na2CO3溶液
你认为可行的是AB.
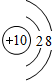 .
.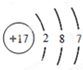 .
.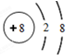
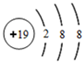 .
.
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +R3COOH
+R3COOH $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CH3COOH
+CH3COOH

 ;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.
;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.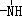 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+. B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应.
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应. .
.