题目内容
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |
B
解析试题分析:在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,相当于减小压强,假设平衡不移动,B的浓度是原来的50%,而达到新的平衡时,B的浓度是原来的60%,则减小压强化学平衡正向移动。A、减小压强化学平衡正向移动,则化学计量数a<b,错误;B、将容器容积增加一倍,相当于减小压强,假设平衡不移动,B的浓度是原来的50%,而达到新的平衡时,B的浓度是原来的60%,则减小压强化学平衡正向移动,正确;C、平衡正向移动,A的转化率增大,错误;D、化学平衡正向移动,B的质量分数增大,错误。
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,相当于减小压强,假设平衡不移动,B的浓度是原来的50%,而达到新的平衡时,B的浓度是原来的60%,则减小压强化学平衡正向移动。A、减小压强化学平衡正向移动,则化学计量数a<b,错误;B、将容器容积增加一倍,相当于减小压强,假设平衡不移动,B的浓度是原来的50%,而达到新的平衡时,B的浓度是原来的60%,则减小压强化学平衡正向移动,正确;C、平衡正向移动,A的转化率增大,错误;D、化学平衡正向移动,B的质量分数增大,错误。
考点:考查化学平衡的移动。

在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.生成l mol C的同时生成l mol D | D.气体的总物质的量 |
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
| A.加热 | B.不用铁片,改用铁粉 |
| C.滴加少量的CuSO4溶液 | D.不用稀硫酸,改用98%浓硫酸 |
在四个不同的容器中,在不同条件下进行反应:N2+3H2 2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
| A.υ(H2)=0.2mol·L-1·s-1 | B.υ(N2)=0.4mol·L-1·min-1 |
| C.υ(NH3)=0.3mol·L-1·s-1 | D.υ(H2)=0.6mol·L-1·min-1 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )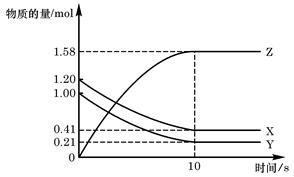
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始到10s, X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s, Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+ Y(g) Z(g) Z(g) |
下列措施一定能使化学反应速率加快的是( )
| A.增大反应物的量 | B.增大压强 | C.升高温度 | D.使用催化剂 |
一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)  Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是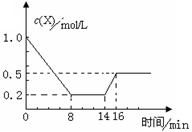
| A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1 |
| B.8min时达到平衡,该反应的平衡常数为K= 0.5 |
| C.14min时,改变的反应条是降低了温度 |
| D.16min时的正反应速率比8min时的正反应速率大 |
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060