题目内容
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
C
解析试题分析:A、实验①中,若5min时测得n(M)=0.050mol,浓度是0.0050mol/L,则根据反应的化学方程式可知,同时生成的N的物质的量也是0.0050mol/L ,因此0至5min时间内,用N表示的平均反应速率υ(N)=0.0050mol/L ÷5min=1.0×10-3mol/(L·min),A不正确;B、实验②中,平衡时M的浓度是0.0080mol/L,则同时生成的N的浓度是0.0080mol/L,消耗X与Y的浓度均是0.0080mol/L,因此平衡时X和Y的浓度分别为0.01mol/L-0.0080mol/L=0.002mol/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数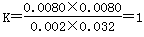 ,B不正确;C、根据反应的化学方程式可知,如果X的转化率为60%,则
,B不正确;C、根据反应的化学方程式可知,如果X的转化率为60%,则
X(g) + Y(g) M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.020 0.030 0 0
转化浓度(mol/L) 0.012 0.012 0.012 0.012
平衡浓度(mol/L)0.008 0.018 0.012 0.012
温度不变,平衡常数不变,则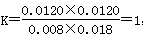 ,即反应达到平衡状态,因此最终平衡时X的转化率为60%。C正确;D、700℃时
,即反应达到平衡状态,因此最终平衡时X的转化率为60%。C正确;D、700℃时
X(g) + Y(g) M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.040 0.010 0 0
转化浓度(mol/L) 0.009 0.009 0.009 0.009
平衡浓度(mol/L)0.031 0.001 0.009 0.009
则该温度下平衡常数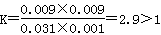 ,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060,D不正确,答案选C。
,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060,D不正确,答案选C。
考点:考查化学反应速率和化学平衡常数的有关判断与计算

在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |
在体积一定的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是 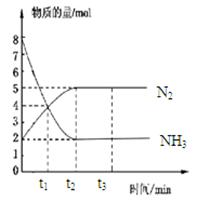
| A.t1时反应达到平衡 |
| B.t3时,v正(N2)﹥v逆(N2) |
| C.t2时和t3时n(H2)相等 |
| D.t3后,若体积不变充He,反应速率增大 |
己知: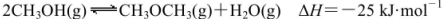 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是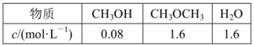
| A.此时刻反应达到平衡状态 |
| B.容器内压强不变时,说明反应达平衡状态 |
| C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D.平衡时,反应混合物的总能量降低40 kJ |
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是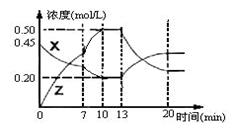
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min) |
| B.化学方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后 |
 B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是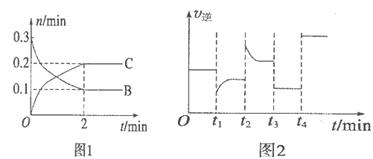
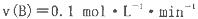

 、
、 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( ) 2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )