题目内容
在四个不同的容器中,在不同条件下进行反应:N2+3H2 2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
| A.υ(H2)=0.2mol·L-1·s-1 | B.υ(N2)=0.4mol·L-1·min-1 |
| C.υ(NH3)=0.3mol·L-1·s-1 | D.υ(H2)=0.6mol·L-1·min-1 |
C
解析试题分析:对于反应N2(g)+3H2(g) 2NH3(g),先统一单位,然后都转化为氢气的反应速率进行判断,A、v(H2)="0.2" mol·L-1·s-1="12" mol·L-1·min-1;B、v(N2)=0.4mol/(L?min),反应速率之比等于其计量数之比,所以v(H2)=3v(N2)="1.2" mol·L-1·min-1;C、v(NH3)="0.3" mol·L-1·s-1="18" mol·L-1·min-1,反应速率之比等于其计量数之比,所以v(H2)=1.5v(NH3)=27mol/(L?min);D、v(H2)=0.6mol/(L?min);选C。
2NH3(g),先统一单位,然后都转化为氢气的反应速率进行判断,A、v(H2)="0.2" mol·L-1·s-1="12" mol·L-1·min-1;B、v(N2)=0.4mol/(L?min),反应速率之比等于其计量数之比,所以v(H2)=3v(N2)="1.2" mol·L-1·min-1;C、v(NH3)="0.3" mol·L-1·s-1="18" mol·L-1·min-1,反应速率之比等于其计量数之比,所以v(H2)=1.5v(NH3)=27mol/(L?min);D、v(H2)=0.6mol/(L?min);选C。
考点:考查化学反应速率大小比较。

在一个恒温恒容的密闭容器中发生如下反应,2A(g)+ B(s)  C(g)+3D(g),不能说明该反应达到平衡的是( )
C(g)+3D(g),不能说明该反应达到平衡的是( )
| A.气体总质量不变 | B.混合气体密度不变 |
| C.反应物B的浓度不变 | D.混合气体平均相对分子质量不再改变 |
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是
| A.加入铜粉,v(H2)增大 |
| B.加入NaHSO4固体,v(H2)不变 |
| C.加入水,锌不与水反应,v(H2)不变 |
| D.加入NaCl固体,会增大Cl-浓度,使v(H2)增大 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )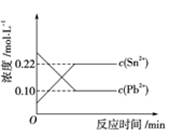
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |
T℃时在2L的密闭容器中X(g)与Y (g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图l所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
A.容器中发生的反应可表示为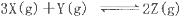 |
B.反应进行的前3 min内,用X表示的反应速率 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
在体积一定的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是 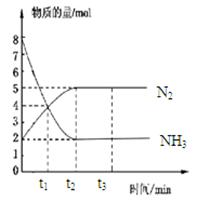
| A.t1时反应达到平衡 |
| B.t3时,v正(N2)﹥v逆(N2) |
| C.t2时和t3时n(H2)相等 |
| D.t3后,若体积不变充He,反应速率增大 |
化学与科学、技术、社会和环境密切相关。下列说法正确的是( )
| A.化学平衡常数是指一定条件下的可逆反应,生成物浓度的幂之积与反应物浓度的幂之积的比值。 |
| B.已知4HCl(g)+O2(g)=2H2O(g)+2Cl2(g) 能自发进行,则该反应ΔH<0,ΔS>0 |
| C.其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 |
| D.铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
 C+5D反应中,表示该反应速率最快的是( )
C+5D反应中,表示该反应速率最快的是( )