题目内容
12.下列关系的比较中,正确的是( )| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
分析 A、离子电子层数越多,离子半径越大;
B、NaHCO3受热易分解,Na2CO3比NaHCO3稳定,碳酸不稳定,易分解;
C、酸性越强,对应的阴离子结合质子的能力越弱;
D、醋酸是弱酸,加水稀释时,促进醋酸的电离.
解答 解:A、K+比Mg2+和Na+多一个电子层,K+半径大,Mg2+与Na+电子层结构相同,核电荷数越大离子半径越小,所以其离子半径K+>Na+>Mg2+,故A错误;
B、碳酸氢钠受热易分解,不稳定,则热稳定性为Na2CO3>NaHCO3>H2CO3,故B错误;
C、酸性碳酸>次氯酸,水为中性,酸性越强,离子的结构质子的能力越弱,故结合质子能力:OH->ClO->HCO3-,故C正确;
D、相同pH的HCl和CH3COOH加水稀释,盐酸中氢离子物质的量不变,醋酸中氢离子物质的量增大,所以稀释相同倍数,pH:CH3COOH<HCl,故D错误;
故选C.
点评 本题考查了离子半径大小比较、物质热稳定性比较、离子结合氢离子能力大小比较、弱酸加水稀释时pH变化,题目难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
2.下列对相应实验现象的描述不正确的是( )
| A. |  左边玻璃球内气体颜色更浅 | B. |  挤压胶头滴管产生喷泉现象 | ||
| C. |  白色沉淀先变黄色再变黑色 | D. | 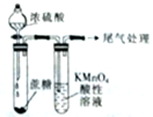 酸性高锰酸钾溶液褪色或变浅 |
3.基态原子的第一电离能处于B、N之间的元素有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
20.仅使用酸性高锰酸钾溶液,无法鉴别的物质组是( )
| A. | Na2S和AlCl3 | B. | 乙烷与乙烯 | C. | 直馏汽油与苯 | D. | CO2与SO2 |
17.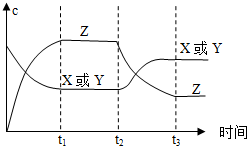 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
4.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正向移动时,下列有关叙述正确的是:( )
①生成物的百分含量一定增加;②生成物的产量一定增加; ③反应物的转化率一定增大;
④反应物的浓度一定降低; ⑤正反应速率一定大于逆反应速率;⑥使用合适的催化剂.
①生成物的百分含量一定增加;②生成物的产量一定增加; ③反应物的转化率一定增大;
④反应物的浓度一定降低; ⑤正反应速率一定大于逆反应速率;⑥使用合适的催化剂.
| A. | ①② | B. | ②⑤ | C. | ②③⑤ | D. | ②③④⑤⑥ |
1. 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
(1)在元素 ①~⑧中,非金属性最强的元素是F(填元素符合).
(2)在元素 ①~⑧中,原子半径最大的是钠(填元素名称).
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(4)用电子式表示元素①和⑧组成的化合物的形成过程 .
.
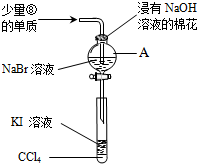
(5)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
①仪器A的名称是分液漏斗,A中发生的反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色.
④VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,电子层数增多,原子半径逐渐增大,得电子能力逐渐减弱.
 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)在元素 ①~⑧中,原子半径最大的是钠(填元素名称).
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(4)用电子式表示元素①和⑧组成的化合物的形成过程
 .
.(5)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
①仪器A的名称是分液漏斗,A中发生的反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色.
④VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,电子层数增多,原子半径逐渐增大,得电子能力逐渐减弱.
2. 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )| A. | 是一种烃 | B. | 属于高分子化合物 | ||
| C. | 属于芳香族化合物 | D. | 分子式是C15H22O5 |