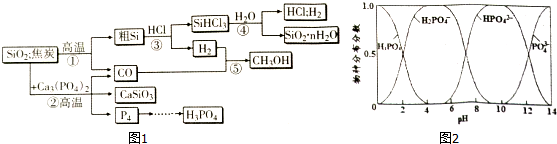
题目内容
2.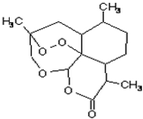 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )| A. | 是一种烃 | B. | 属于高分子化合物 | ||
| C. | 属于芳香族化合物 | D. | 分子式是C15H22O5 |
分析 由结构可知,由C、H、O元素组成,不含苯环、相对分子质量在10000以下,由结构可知分子式,以此来解答.
解答 解:A.含O元素,为烃的衍生物,故A错误;
B.相对分子质量在10000以下,不是高分子化合物,故B错误;
C.不含苯环,不属于芳香族化合物,故C错误;
D.由结构可知,分子中含15个C、22个H、5个O,则分子式是C15H22O5,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握常见的官能团及性质的关系,把握有机物的结构及相关概念是解答的关键,题目难度不大.

练习册系列答案
相关题目
12.下列关系的比较中,正确的是( )
| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
13.下列说法正确的是( )
| A. | 同一原子中,2p、3p、4p能级的轨道数依次增多 | |
| B. | 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 | |
| C. | 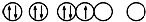 表示的原子能量处于最低状态 表示的原子能量处于最低状态 | |
| D. | 在离核最近区域内运动的电子能量最低 |
10.下列关于化学键的说法正确的是( )
| A. | 阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 | |
| B. | 根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成 |
17.某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{Am}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
7.按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )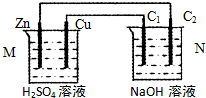

| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
18.下列原因解释与氢键无关的( )
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |
19.下列反应中,反应前后溶液颜色不发生变化的是( )
| A. | 乙烯通入酸性高锰酸钾溶液 | |
| B. | 氯气用足量氢氧化钠溶液吸收 | |
| C. | 铁粉投入硫酸铜溶液 | |
| D. | 往淀粉和碘化钾的混合溶液中滴加适量的氯化铁溶液 |