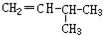题目内容
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
分析 A.过氧化钠和水反应,过氧化钠既是氧化剂又是还原剂,1 mol Na2O2和水的反应,转移1mol电子;
B.氯气中氯原子形成一对共用电子对,每个氯原子含有3对孤对电子;
C.溶液体积未知;
D.氨水中除去氨气含有氢原子,水中也含有氢原子.
解答 解:A.1 mol Na2O2和水的反应,转移1mol电子,0.1mol Na2O2与水反应转移电子数目为0.1NA,故A正确;
B.氯气中氯原子形成一对共用电子对,每个氯原子含有3对孤对电子,标况下,2.24LCl2的物质的量为0.1mol,含孤电子对的数目为0.6NA,故B错误;
C.溶液体积未知,无法计算氢离子的物质的量,故C错误;
D.氨水中氨气和水都含有氢原子,在10g质量分数为17%的氨水中,含有H的数目大于0.3NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的分析应用,质量换算物质的量计算微粒数,氧化还原反应电子转移计算,题目难度不大.

练习册系列答案
相关题目
6.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
16.某烃的一种同分异构体的一氯代物只有一种,该烃的分子式是( )
| A. | C6H14 | B. | C5H12 | C. | C4H10 | D. | C3H8 |
3.下列叙述中正确的是( )
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
13.下列说法正确的是( )
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 32g O2含原子数目为2NA | |
| C. | 标准状况下,18g H2O所占的体积为22.4L | |
| D. | 在同温同压下,相同体积任何气体单质所含的原子数目相同 |
18.下列化学反应的离子方程式正确的是( )
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
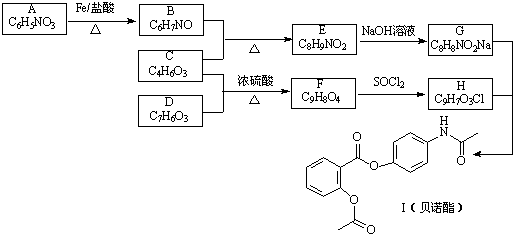
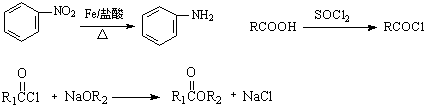
 ,G
,G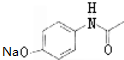 .
. .
. .
. 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)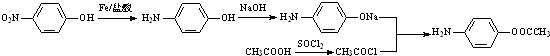 .
.
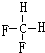 和
和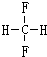
 和CH2=CH-CH2
和CH2=CH-CH2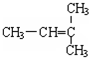 和
和