题目内容
10.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A.非金属性X(O)>W(S),故W元素的简单气态氢化物的还原性比X的弱,故A错误;
B.非金属Z(Si)<W(S),故硫酸的酸性比硅酸强,故B错误;
C.MgO含有离子键,SiO2、SO3含有共价键,故C错误;
D.同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>Si>S>O,即rY>rZ>rW>rX,故D正确,
故选:D.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
20.如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
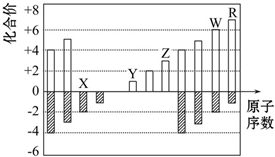

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一种强酸 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
1.化学与社会、生活密切相关,下列有关说法不正确的是( )
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
5.下列电子式正确的是( )
| A. | H2O2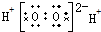 | B. | HClO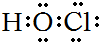 | C. | MgCl2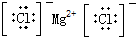 | D. | CCl4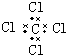 |
15.下列说法正确的是( )
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
2.恒温条件下用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
19.具有下列电子排布式的原子中,半径最大的是( )
| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
20.下列各组比较中正确的是( )
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
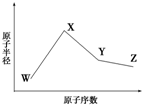 已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体
已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体