题目内容
5.下列电子式正确的是( )| A. | H2O2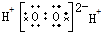 | B. | HClO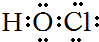 | C. | MgCl2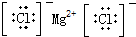 | D. | CCl4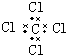 |
分析 A、双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
B、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
C、氯化镁为离子化合物,必须标出阴阳离子的电子式;
D、四氯化碳中碳原子和氯原子均满足8电子稳定结构.
解答 解:A、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故A错误;
,故A错误;
B、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为 ,故B正确;
,故B正确;
C、氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,故C正确;
,故C正确;
D、四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为 ,故D错误,
,故D错误,
故选BC.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
15.硫和硒(Se)、磷(Te)为同主族元素,在生产、生活中有着广泛用途.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:
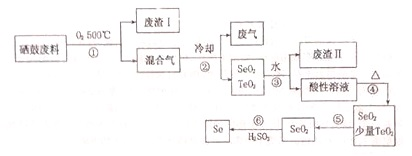
已知:
(1)硒的最高价氧化物对应水化合物化学式:H2SeO4;
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:

已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
16.在8NH3+3Cl2→6NH4Cl+N2反应中,若有10.2gNH3被氧化,则反应用去的氯气在标准状况下体积为( )
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
13.某短周期元素R原子的最外层P轨道上的未成对电子只有2个.下列关于R的描述中正确的是( )
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO3 | |
| C. | R是非金属元素 | |
| D. | R的氧化物都能与NaOH溶液反应 |
20.某无色溶液加入铝可以生成氢气,则在该溶液中可能大量存在的离子组是( )
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、K+、NH4+、Cl- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Cu2+、Br-、Cl- |
10.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
. 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: