题目内容
19.具有下列电子排布式的原子中,半径最大的是( )| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
分析 先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小.
解答 解:A是N元素,B是Al元素,C是C元素,D是S元素,
N、C有2个电子层,Al、S有3个电子层,所以Al、S的原子半径大于C、N的原子半径;Al、S是同周期元素,Al的原子序数小于S的原子序数,由元素周期律知,Al的原子半径大于S的原子半径,则Al的原子半径最大.
故选B.
点评 本题考查了电子排布式、原子半径大小的比较,难度不大,注意原子半径大小的比较方法.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
10.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
7.2011年3月,日本因发生9.0级特大地震而导致核电站的放射性物质严重泄漏.放射性物质主要包括${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs,${\;}_{53}^{131}$I可能会引发甲状腺疾病,${\;}_{55}^{137}$Cs则会造成人体造血系统和神经系统损伤.下列关于${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的说法错误的是( )
| A. | ${\;}_{53}^{127}$I、${\;}_{53}^{131}$I、${\;}_{55}^{134}$Cs、${\;}_{55}^{137}$Cs是四种核素,两组同位素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的中子数分别是78、82 | |
| C. | 在周期表中Cs与I位于同一周期 | |
| D. | 铯与碘能化合生成CsI |
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式的1s22s2的Y原子 | |
| B. | 原子核外L层仅有两个电子的X原子与原子核外M层仅有两个电子的Y原子 | |
| C. | 2p轨道只有一个未成对电子的X原子和3P轨道只有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
8.下列有机物的命名正确的是( )
| A. | (CH3)2CHCH2CH(CH3)CH(CH3)2 2,4,5-三甲基己烷 | |
| B. | 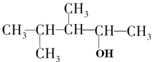 1,2,3-三甲基-1-丁醇 1,2,3-三甲基-1-丁醇 | |
| C. | CH2=C(CH3)CH2C(CH3)32,4,4-三甲基-1-戊烯 | |
| D. | CH3COOCH2CH2OOCCH3 乙二酸乙二酯 |
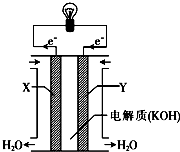 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: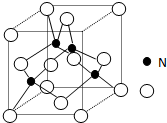 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域