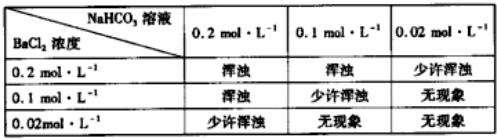
题目内容
20.下列各组比较中正确的是( )| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
分析 A.依据同主族元素从上到下金属性依次增强解答;
B.钾性质活泼,与盐溶液反应,先于水反应;
C.铯是金黄色;
D.金属性越强,元素对应最高价氧化物水化物碱性越强.
解答 解:A.同主族元素从上到下金属性依次增强,钠在锂的下面,与水反应更剧烈,故A正确;
B.还原性:K>Na>Li,但是K与NaCl的水溶液反应,先与水反应,不能置换钠,故B错误;
C.Li、Na、K、Rb等碱金属单质都是银白色,铯是金黄色,故C错误;
D.金属性越强,元素对应最高价氧化物水化物碱性越强,因为金属性K>Na>Li,所以LiOH<NaOH<KOH,故D错误;
故选:A.
点评 本题考查了碱金属性质,明确同主族元素性质的递变规律、金属性强弱的判断依据是解题关键,题目难度不大.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
10.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
8.下列有机物的命名正确的是( )
| A. | (CH3)2CHCH2CH(CH3)CH(CH3)2 2,4,5-三甲基己烷 | |
| B. | 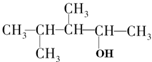 1,2,3-三甲基-1-丁醇 1,2,3-三甲基-1-丁醇 | |
| C. | CH2=C(CH3)CH2C(CH3)32,4,4-三甲基-1-戊烯 | |
| D. | CH3COOCH2CH2OOCCH3 乙二酸乙二酯 |
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
5.化学与人类生活密切相关.关于下列物质的使用不合理的是( )
| A. | 二氧化硫常用于食品增白 | B. | 碳酸氢钠常用于焙制糕点 | ||
| C. | 醋酸常用于除去水壶内的水垢 | D. | 氢氧化铝常用于治疗胃酸过多 |
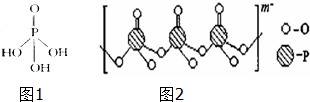 磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: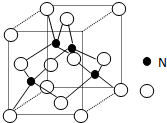 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域