题目内容
17.某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是( )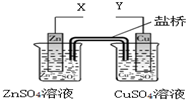
| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
分析 A、活泼的金属锌作负极;
B、阴离子向负极移动;
C、电解池的阳极是活泼电极,则电极本身失电子发生氧化反应;
D、电解池的阳极是活泼电极,则电极本身失电子发生氧化反应.
解答 解:A、X和Y与电流表连接,会构成原电池,活泼的金属锌作负极,发生氧化反应,故A错误;
B、阴离子向负极移动,所以盐桥中的阴离子移向ZnSO4溶液,故B错误;
C、X和Y分别与电源“-”、“+”极相连,则Cu做了电解池的阳极,则电极Cu本身失电子发生氧化反应,质量减轻,Zn极析出金属锌质量增加,故C正确;
D、X和Y分别与电源“+”、“-”极相连,Zn是阳极,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,故D错误.
故选C.
点评 本题考查原电池和电解池,侧重反应原理的考查,考查点较全面细致,注重学生基础知识和基本能力的考查,题目难度不大.

练习册系列答案
相关题目
8.在给定条件下,下列画线物质在化学反应中能被完全消耗的是( )
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
8.下列鉴别方法一定不可行的是( )
| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
12.甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景,现有如下实验:在体积为1L的密闭容器中,充入1mol CH3OH和1mol H2O,一定条件下发生反应:
CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
(1)已知:CH3OH(g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ/mol K1
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.
CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.
2.下列物质完全燃烧时,只要总质量相同,所产生的CO2的量也一定相同的是( )
| A. | 乙酸乙酯和葡萄糖 | B. | 葡萄糖和果糖 | ||
| C. | 乙醇和乙烯 | D. | 麦芽糖和葡萄糖 |
9.已知外电路中,电子由铜流向a极.有关如图所示装置的分析中,合理的一项是( )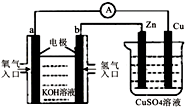

| A. | 一段时间后Zn电极逐渐溶解 | |
| B. | 该装置中Cu极为正极,发生还原反应 | |
| C. | b极反应的电极反应式为:H2-2e-=2H+ | |
| D. | 电流方向:a电极→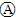 →Cu电极 →Cu电极 |
4.磷灰石是生产磷肥的原料,它的组成可以看作是Ca5(PO4)xF、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
(1)在化学式Ca5(PO4)xF中,x的值是3.
(2)磷灰石中,磷元素和碳元素的物质的量之比是0.80:1(保留两位小数)
(3)磷灰石中,CaSO4的质量分数为5.95%(保留两位小数)
(4)取50.00g磷灰石粉末,加入足量的浓硫酸,并加热,该元素全部以CaSO4的形式存在,可以得到CaSO457.12g(保留两位小数)
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(2)磷灰石中,磷元素和碳元素的物质的量之比是0.80:1(保留两位小数)
(3)磷灰石中,CaSO4的质量分数为5.95%(保留两位小数)
(4)取50.00g磷灰石粉末,加入足量的浓硫酸,并加热,该元素全部以CaSO4的形式存在,可以得到CaSO457.12g(保留两位小数)
 氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题:
氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题: