题目内容
12.甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景,现有如下实验:在体积为1L的密闭容器中,充入1mol CH3OH和1mol H2O,一定条件下发生反应:CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式得到反应焓变;
(2)依据反应速率概念计算,v=$\frac{△c}{△t}$计算得到二氧化碳的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到氢气反应速率;
(3)结合平衡常数概念书写反应的平衡常数表达式计算得到K和K1、K2的关系;
(4)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量.
解答 解:(1)①CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2(g)?H1=-192.9kJ/mol K1
②H2(g)+$\frac{1}{2}$O2(g)?H2O(g)?H2=-120.9kJ/mol K2
结合盖斯定律计算①-②得到甲醇与水蒸气催化重整反应的热化学方程式为:CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H3=-72KJ/mol;
故答案为:-72.0kJ/mol;
(2)10~30min内,二氧化碳的反应速率v(CO2)=$\frac{0.6mol/L-0.2mol/L}{30min-10min}$=0.02mol/L•min,氢气的平均反应速率v(H2)=3v(CO2)=0.06mol/L•min;
故答案为:0.06;
(3)K1=$\frac{[C{O}_{2}]•[{H}_{2}]^{2}}{[C{H}_{3}OH]•[{O}_{2}]^{\frac{1}{2}}}$
K2=$\frac{[{H}_{2}O]}{[{H}_{2}]•[{O}_{2}]^{\frac{1}{2}}}$
K3=$\frac{[C{O}_{2}]•[{H}_{2}]^{3}}{[C{H}_{3}OH]•[{H}_{2}O]}$=$\frac{{K}_{1}}{{K}_{2}}$;
故答案为:$\frac{{K}_{1}}{{K}_{2}}$;
(3)CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD.
点评 本题主要考查化学反应速率、平衡图象、化学平衡常数、平衡状态的判断,难度中等,注意基础知识的理解掌握.

 名校课堂系列答案
名校课堂系列答案| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a |
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |

| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
| A. | 乙醇可由淀粉、纤维素等在一定条件下制得 | |
| B. | 乙醇、乙酸生成乙酸乙酯的反应属于取代反应 | |
| C. | 乙醇可与NaOH稀溶液反应 | |
| D. | 乙醇与二甲醚(CH3 OCH3)是同分异构体 |
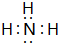 .
.
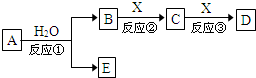 由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).
由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).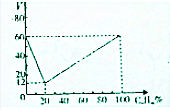 分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )
分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )