题目内容
4.磷灰石是生产磷肥的原料,它的组成可以看作是Ca5(PO4)xF、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(2)磷灰石中,磷元素和碳元素的物质的量之比是0.80:1(保留两位小数)
(3)磷灰石中,CaSO4的质量分数为5.95%(保留两位小数)
(4)取50.00g磷灰石粉末,加入足量的浓硫酸,并加热,该元素全部以CaSO4的形式存在,可以得到CaSO457.12g(保留两位小数)
分析 (1)根据化合价代数和为0计算x的值;
(2)磷灰石中,磷元素和碳元素可根据P2O5和CO2的质量分数计算;
(3)根据SO3计算CaSO4的质量分数;
(4)加入足量的浓硫酸,生成CaSO4的质量可根据CaO的质量分数计算.
解答 解:(1)化学式Ca5(PO4)xF中,Ca为+2价、P为+5价、O为-2价,F为-1价,则2×5=3x+1,x=3,故答案为:3;
(2)灰石中,P2O5和CO2的质量分数分别为28.40%、6.10%,则磷元素和碳元素的物质的量之比为$\frac{28.40%×2}{142}$:$\frac{6.10%}{12}$=0.80:1,故答案为:0.80;
(3)已知磷灰石中SO3的质量分数为3.50%,则CaSO4的质量分数为$\frac{136}{80}×3.50%$=5.95%,故答案为:5.95;
(4)50.00g磷灰石粉末中n(CaO)=$\frac{50g×47.30%}{56g/mol}$=0.42mol,n(CaSO4)=n(CaO)=0.42mol,m(CaSO4)=0.42mol×136g/mol=57.12g,
故答案为:57.12.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握计算思路和方法,难度不大.

练习册系列答案
相关题目
17.某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是( )


| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
15.下列关于有机物的说法正确的是( )
| A. | 甲烷和苯都能发生氧化反应和取代反应 | |
| B. | 乙烯和聚氯乙烯都能发生加成反应 | |
| C. | 乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 | |
| D. | 淀粉、纤维素水解的最终产物互为同分异构体 |
12.C2H5OH的官能团-OH,含有-OH的物质具有与乙醇类似的化学性质,在Cu或Ag的催化下,下列物质不能与O2发生氧化反应的是( )
| A. | CH3CH2CH2CH2OH | B. |  | C. | 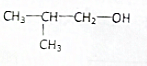 | D. | 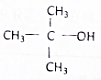 |
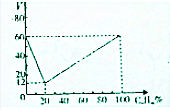 分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )
分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )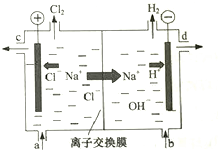 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.