题目内容
5.在室温下C2H2 、CH4 和H2组成的混合气体100mL,与过量空气反应所得气态混合物恢复至原来的温度和压强,体积缩小了180mL,则原混合气体中CH4体积为多少.分析 根据甲烷、氢气和乙炔的燃烧方程式可知,等体积的乙炔、氢气在燃烧过程中气体缩小体积相同,可设出乙炔、氢气的总体积为x,甲烷的体积为y,然后利用总体积及差量法列式计算即可.
解答 解:根据C2H2 、CH4 和H2的燃烧方程式可知,
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O(l) 体积减小△V
1 2 1 2
C2H2+2.5O2$\stackrel{点燃}{→}$2CO2+H2O(l)?体积减小△V
1 2.5 2 1.5
H2+0.5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)?体积减小△V
1 0.5 1.5,
设混合气体中乙炔和氢气的总体积为xmL,甲烷的体积为ymL,
则:x+y=100mL、1.5x+2y=180,联立解得:x=40、y=60,
即:混合气体中甲烷的体积为60mL,
答:原混合气体中CH4体积为60mL.
点评 本题考查了混合物反应的计算,题目难度中等,根据反应方程式得出等体积时氢气、乙炔完全燃烧时气体减小体积相等为解答关键,注意掌握差量法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
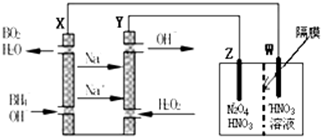
17.某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是( )


| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
14. 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
①C ②H2O2 ③Al ④Fe ⑤HNO3 ⑥H2S.
 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①C ②H2O2 ③Al ④Fe ⑤HNO3 ⑥H2S.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 全部 |
1.“保护环境,就是保护人类自己.”下列环境问题与其产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NOx等引起的
③“赤潮”主要是由水体中P、N等元素过量引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“酸雨”主要是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的.
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NOx等引起的
③“赤潮”主要是由水体中P、N等元素过量引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“酸雨”主要是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的.
| A. | 只有① | B. | 只有②③⑤ | C. | 只有⑤ | D. | 全部 |
9.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46 g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4 L四氯化碳中所含有的共价键数目为4NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA | |
| D. | 常温常压下,33.6 L氯气与56 g铁充分反应,转移的电子数为3NA |
15.下列关于有机物的说法正确的是( )
| A. | 甲烷和苯都能发生氧化反应和取代反应 | |
| B. | 乙烯和聚氯乙烯都能发生加成反应 | |
| C. | 乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 | |
| D. | 淀粉、纤维素水解的最终产物互为同分异构体 |
12.C2H5OH的官能团-OH,含有-OH的物质具有与乙醇类似的化学性质,在Cu或Ag的催化下,下列物质不能与O2发生氧化反应的是( )
| A. | CH3CH2CH2CH2OH | B. |  | C. | 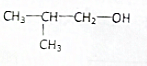 | D. | 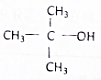 |