题目内容
5. 氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题:
氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题:(1)V原子的核外电子排布式为1s22s22p63s23p63d34s2.如右图所示为一个完整的CaF2晶胞,则图中白球表示Ca2+ (填“F-”或“Ca2+”).设晶胞边长为a,则Ca2+与F-之间的最近距离为$\frac{\sqrt{3}a}{4}$.
(2)OF2分子中氧原子的轨道杂化类型为sp3,OF2被称为氟化物而不被称为氧化物的原因是氧化物中氧元素的化合价为-2,而在OF2中氧元素的化合价为+2价.
(3)O2F2是一种强氧化剂,由O2和F2在低温下合成,运用VSEPR模型给出,O2F2是极性(填“极性”或“非极性”)分子.
(4)氢氟酸是一种弱酸,其原因是HF分子之间以氢键的方式结合.
分析 (1)V原子是23号,其核外电子排布式为1s22s22p63s23p63d34s2(或[Ar]3d34s2);利用均摊法计算钙离子和氟离子的个数,然后判断;把晶胞分成8个小的立方体如图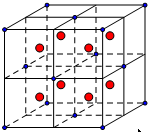 ,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半;
,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半;
(2)根据O原子的价层电子对数判断;根据OF2中O元素的化合价分析;
(3)O2F2中O原子的价层电子对数为4,其中含有2个孤电子对,为V形结构;
(4)氢氟酸分子之间形成氢键,电离程度较小.
解答 解:(1)V原子是23号,其核外电子排布式为1s22s22p63s23p63d34s2(或[Ar]3d34s2);CaF2晶胞中,白球的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑球全部在晶胞内部,数目为8,则图中白球是钙离子;把晶胞分成8个小的立方体如图 ,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半,已知晶胞边长为a,则小立方体的边长为$\frac{a}{2}$,设Ca2+与F-之间的最近距离为x,
,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半,已知晶胞边长为a,则小立方体的边长为$\frac{a}{2}$,设Ca2+与F-之间的最近距离为x,
则($\frac{a}{2}$)2+($\frac{a}{2}$)2+($\frac{a}{2}$)2=x2,解得x=$\frac{\sqrt{3}a}{4}$;
故答案为:1s22s22p63s23p63d34s2(或[Ar]3d34s2);Ca2+;$\frac{\sqrt{3}a}{4}$;
(2)OF2分子中氧原子为2+$\frac{1}{2}$(6-2×1)=4,属于sp3杂化;OF2中F元素为-1价,O元素的化合价为+2价,而氧化物中O元素的化合价为-2价,所以OF2被称为氟化物;
故答案为:sp3;氧化物中氧元素的化合价为-2,而在OF2中氧元素的化合价为+2价;
(3)O2F2中O原子的价层电子对数为4,其中含有2个孤电子对,为V形结构,分子结构不对称,正负电荷中心不重叠,属于极性分子;
故答案为:极性;
(4)氢氟酸分子之间形成氢键,电离程度较小,即HF在溶液中不能完全电离,所以HF为弱酸;
故答案为:HF分子之间以氢键的方式结合.
点评 本题考查了电子排布式、晶胞的分析与计算、杂化理论的应用、分子极性的判断、氢键等,题目涉及的知识点较多,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握晶胞的计算方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 属于羧基类的有2种 | |
| B. | 属于酯类的有3种 | |
| C. | 存在分子中含有六元环的同分异构体 | |
| D. | 分子中可含有两种不同的官能团 |
| A. | 受热时,碳酸氢钠比碳酸钠容易分解 | |
| B. | 碳酸氢钠俗名纯碱,碳酸钠俗名苏打 | |
| C. | 碳酸氢钠溶液显酸性,碳酸钠溶液显碱性 | |
| D. | 分别向等物质的量的两种白色粉末中加入等体积等浓度的稀盐酸,生成气体的速率,碳酸氢钠比碳酸钠慢 |
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |
| A. | 酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| B. | 0.03mol/L NH4Al(SO4)2溶液与0.05mol/l Ba(OH)2溶液等体积混合:NH4++3Al3++5SO42-+5Ba2++10 OH-═5BaSO4↓+3Al(OH)3↓+NH3•H2O | |
| C. | 向烧碱溶液中加少量Ca(HCO3)2溶液:HCO3-+Ca2+OH-=CaCO3↓+2H2O | |
| D. | 在强碱溶液中次氯酸钠与氢氧化铁反应生成:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |

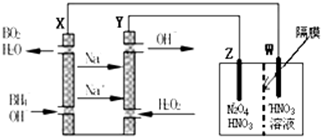
| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①C ②H2O2 ③Al ④Fe ⑤HNO3 ⑥H2S.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 全部 |
| A. | CH3CH2CH2CH2OH | B. |  | C. | 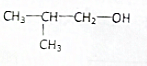 | D. | 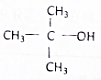 |