��Ŀ����
����Ŀ��̼���仯����㷺��������Ȼ�硣��ش��������⣺
(1)��CO2��NH3Ϊԭ�Ͽɺϳ����ء���֪
��2NH3(g)+CO2(g)=NH2COONH4(s) ��H=��159.47 kJ��mol��1
��NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.49 kJ��mol��1
��H2O(l)=H2O(g) ��H=+88.0 kJ��mol��1
д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ______________________________��
(2)�����ǵ�����̼Ԫ�ص�������ճء�
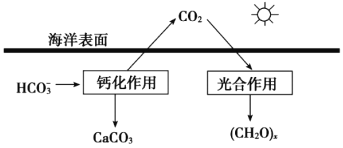
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ�����CO2��H2CO3��___________��___________��
���ں���̼ѭ���У���ͨ����ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ___________��
(3)���³�ѹ�£������е�CO2����ˮ�дﵽƽ��ʱ����ת����ϵ���£�
��CO2+H2O![]() H2CO3 K=1.8��10��3
H2CO3 K=1.8��10��3
��H2CO3![]() H++HCO3�� Ka1=4.3��10��7��
H++HCO3�� Ka1=4.3��10��7��
��HCO3��![]() H++CO32�� Ka2=5.6��10��11
H++CO32�� Ka2=5.6��10��11
ͨ������£���ˮ��pHԼΪ8��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬����Һ��c(CO2)=____________________________________________mol/L��(������λ��Ч����)
(4)Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ����N2����CO2������NaOH��Һ���ա���1.0mol/L����ζ�����Һ�����ɵ�V(CO2)��V(����)�仯��ϵ��ͼ1��ʾ��������Һ������Ũ���ɴ�С��˳��Ϊ__________����ˮ����̼��Ũ��Ϊ___________mol/L��
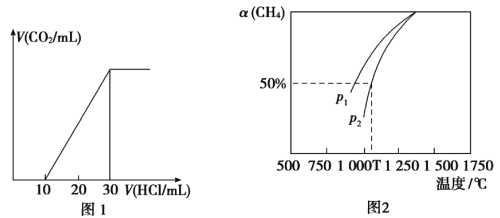
(5)��CO2����Ȼ�������Ʊ�CO��H2��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����ѹǿp1___________p2(�>����<)����p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=___________MPa2(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����ѹǿp1___________p2(�>����<)����p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=___________MPa2(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
���𰸡�![]() HCO3�� CO32-
HCO3�� CO32- ![]() 1.3��10-7 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+) 0. 2 < 4
1.3��10-7 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+) 0. 2 < 4
��������
(1)�����Ͷ�����̼�������صķ���ʽΪ�� ![]() ����Ӧ���ڢ�+��-�ۣ����Ȼ�ѧ����ʽΪ��
����Ӧ���ڢ�+��-�ۣ����Ȼ�ѧ����ʽΪ��![]() ��
��
(2) ����ͼ�п��Կ�����������һ����ʽΪHCO3�������ݵ��룬����֪������һ����ʽΪCO32-������ͼ�У��ƻ������У�1�ַ�Ӧ��HCO3������������CaCO3��CO2������ԭ���غ㣬����֪����һ�ַ�Ӧ��ΪCa2+�����Ը���ԭ���غ�͵���غ�д������ʽ��![]() ��
��
��3��pH����8����c(CO2)��Ҫ�ҵ����ߵĹ�ϵ������ˮ�ĵ����̼��ĵڶ������롣�ɽ���Ӧ�٢�������ӣ���CO2+H2O![]() H++HCO3�����÷�Ӧ��ƽ�ⳣ��=K��Ka1=
H++HCO3�����÷�Ӧ��ƽ�ⳣ��=K��Ka1=![]() �����ݵ�һ�����뷽��ʽH+��HCO3-��Ũ����ͬ��pH=8��c(H+)=10-8��
�����ݵ�һ�����뷽��ʽH+��HCO3-��Ũ����ͬ��pH=8��c(H+)=10-8��![]() �������c(CO2)Ϊ1.3��10-7mol/L��
�������c(CO2)Ϊ1.3��10-7mol/L��
��4������ͼ��0~10mL�ĽΣ�û���������ɣ�������Ӧ��![]() ��֮�����������ɣ�������Ӧ��
��֮�����������ɣ�������Ӧ��![]() ����֪Na2CO3��NaHCO3�����ʵ���֮��1:1��ע����Ȼ�ڶ�����Ӧ��������20mLHCl������һ����NaHCO3�����ڵ�һ����Ӧ��CO32-��ˮ��������HCO3-������ǿ����Һ�ʼ��ԣ�������Ϊ��c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)��100mL�ĺ�ˮ������ͼ��ĵڶ���������20mL 1mol/L��HCl���ɵ�CO2Ϊ0.02mol������ˮ����̼��Ũ��Ϊ0.02mol��0.1L=0. 2mol/L��
����֪Na2CO3��NaHCO3�����ʵ���֮��1:1��ע����Ȼ�ڶ�����Ӧ��������20mLHCl������һ����NaHCO3�����ڵ�һ����Ӧ��CO32-��ˮ��������HCO3-������ǿ����Һ�ʼ��ԣ�������Ϊ��c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)��100mL�ĺ�ˮ������ͼ��ĵڶ���������20mL 1mol/L��HCl���ɵ�CO2Ϊ0.02mol������ˮ����̼��Ũ��Ϊ0.02mol��0.1L=0. 2mol/L��
(5)ͬһ�¶��£�p1�������£�CH4��ת���ʸ��ߡ����ݷ���ʽ��������������ӵķ�Ӧ������ѹǿ�������������С�ķ����ƶ���CH4��ת���ʸ�С����p1< p2��
CO2(g) + CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
��ʼŨ�� 0.1mol/L 0.1mol/L 0 0
ת��Ũ�� 0.05mol/L 0.05mol/L 0.1mol/L 0.1mol/L
ƽ��Ũ�� 0.05mol/L 0.05mol/L 0.1mol/L 0.1mol/L
�ܵ����ʵ���Ũ��Ϊ0.3mol/L��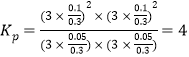 ��
��
(1)���ݸ�˹���ɼ��㣬��+��-�ۣ����Ȼ�ѧ����ʽΪ��![]() ��
��
(2) ����ͼ�п��Կ�������������ʽΪHCO3�������ݵ��룬��֪��ΪCO32-������ͼ�У�����ԭ���غ�͵���غ㣬��д������ʽ��![]() ��
��
��3��pH����8����Ӧ�٢���ӣ���CO2+H2O![]() H++HCO3�����÷�Ӧ��ƽ�ⳣ��=K��Ka1=
H++HCO3�����÷�Ӧ��ƽ�ⳣ��=K��Ka1=![]() �����ݵ�һ�����뷽��ʽH+��HCO3-��Ũ����ͬ��pH=8��c(H+)=10-8��
�����ݵ�һ�����뷽��ʽH+��HCO3-��Ũ����ͬ��pH=8��c(H+)=10-8��![]() �������c(CO2)Ϊ1.3��10-7mol/L��
�������c(CO2)Ϊ1.3��10-7mol/L��
��4������ͼ��0~10mL�ĽΣ�û���������ɣ�������Ӧ��![]() ��֮�����������ɣ�������Ӧ��
��֮�����������ɣ�������Ӧ��![]() ����Na2CO3��NaHCO3�����ʵ���֮��1:1��ע����Ȼ�ڶ�����Ӧ��������20mLHCl������һ����NaHCO3�����ڵ�һ����Ӧ��CO32-��ˮ��������HCO3-������ǿ����Һ�ʼ��ԣ�������Ϊ��c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)��100mL�ĺ�ˮ������ͼ��ĵڶ���������20mL 1mol/L��HCl���ɵ�CO2Ϊ0.02mol�����ˮ����̼��Ũ��Ϊ0.02mol��0.1L=0. 2mol/L��
����Na2CO3��NaHCO3�����ʵ���֮��1:1��ע����Ȼ�ڶ�����Ӧ��������20mLHCl������һ����NaHCO3�����ڵ�һ����Ӧ��CO32-��ˮ��������HCO3-������ǿ����Һ�ʼ��ԣ�������Ϊ��c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)��100mL�ĺ�ˮ������ͼ��ĵڶ���������20mL 1mol/L��HCl���ɵ�CO2Ϊ0.02mol�����ˮ����̼��Ũ��Ϊ0.02mol��0.1L=0. 2mol/L��
(5)ͬһ�¶��£�p1�������£�CH4��ת���ʸ��ߡ����ݷ���ʽ��������������ӵķ�Ӧ������ѹǿ�������������С�ķ����ƶ���CH4��ת���ʸ�С����p1< p2��
CO2(g) + CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
��ʼŨ�� 0.1mol/L 0.1mol/L 0 0
ת��Ũ�� 0.05mol/L 0.05mol/L 0.1mol/L 0.1mol/L
ƽ��Ũ�� 0.05mol/L 0.05mol/L 0.1mol/L 0.1mol/L
�ܵ����ʵ���Ũ��Ϊ0.3mol/L��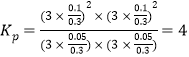 ��
��



