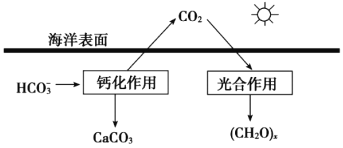
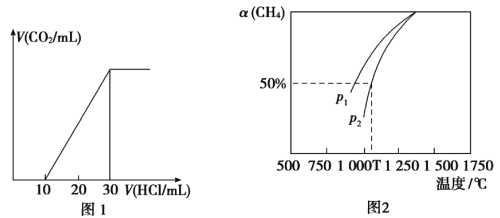
题目内容
【题目】下列变化中,反应物的总能量小于生成物的总能量的是
A. 甲烷燃烧B. 铝热反应C. 碳酸钙分解D. 酸碱中和
【答案】C
【解析】
反应中反应物的总能量小于生成物的总能量,说明该反应为吸热反应,
A.甲烷燃烧为放热反应,故A错误;
B.铝热反应为放热反应,故B错误;
C.碳酸钙分解需要吸热,为吸热反应,故C正确;
D.酸碱中和为放热反应,故D错误。
故选C。

【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。