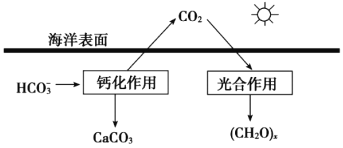
题目内容
【题目】下列事实,不能用勒夏特列原理解释的是
A. 溴水中有平衡:Br2+ H2O ![]() HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
B. 对CO + NO2 ![]() CO2+ NO,平衡体系增大压强可使颜色变深
CO2+ NO,平衡体系增大压强可使颜色变深
C. 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
【答案】B
【解析】
如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,这就是勒夏特列原理的内容,注意对于反应前后体积不变的反应,压强不影响该平衡。
A项、溴水中存在下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释,故A错误;
HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释,故A错误;
B项、反应前后体积不变,缩小体积增大压强,平衡不移动,但物质的浓度会增大,所以颜色加深,不能用勒夏特利原理解释,故B正确;
C项、电解硫酸钠溶液时,溶液中水电离生成氢离子和氢氧根离子,阴极上氢离子放电生成氢气,从而促进水电离,导致溶液中氢氧根离子浓度增大,溶液呈碱性,无色酚酞试液遇碱变红色,可以用勒夏特列原理解释,故C错误;
D项、合成氨反应为放热反应,降低温度平衡正向移动,氨的产率提高,能用勒夏特利原理解释,故D错误。
故选B。

【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大