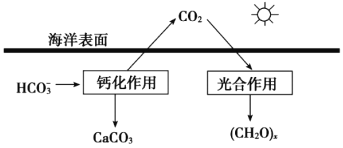
题目内容
【题目】据报道,1996年8月,我国科学家首次制出一种新核素镅—235,已知镅(Am)的原子序数为95,下列关于![]() 的叙述正确的是
的叙述正确的是
A. 镅—235与铀—235具有相同的质子数
B. 镅—235的原子质量是12C原子质量的235倍
C. 镅—235原子核内中子数为140,核外电子数为95
D. 镅—235原子一定不具有放射性
【答案】C
【解析】
A、镅—235与铀—235的质量数均为235,具有相同的质量数,故A错误;
B、质量数是相对原子质量的近似整数值,镅—235的原子质量约为12C原子质量的![]() 倍,故B错误;
倍,故B错误;
C、质量数=质子数+中子数,镅—235原子核内中子数=235-95=140,核外电子数等于质子数=95,故C正确;
D、镅—235属于锕系乙酸,具有放射性,故D错误;
故选C。

【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大