题目内容
10.分子式为C6H14O且在铜或银做催化剂的条件下,可以被空气中的氧气氧化成醛的醇有(不考虑立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 在铜或银催化剂的条件下可以被空气中的氧气氧化为醛说明该物质为醇,且与羟基相连的碳上含有2个氢原子,据此解题.
解答 解:分子式为C6H14O的有机物,它的同分异构体中,经氧化可生成醛,该有机物属于醛,且连接羟基的碳原子上含有两个氢原子,确定C6H14的同分异构体,-OH取代C6H14中甲基上的H原子,
C6H14的同分异构体有:①CH3CH2CH2CH2CH2CH3、②CH3CH2CH2CH(CH3)2、③CH3CH2CH(CH3)CH2CH3、④CH3CH2C(CH3)3、⑤CH(CH3)2CH(CH3)2、
①中甲基处于对称位置,-OH取代甲基上的H原子有1种结构;
②中甲基有2种,-OH取代甲基上的H原子有2种结构;
③中甲基有2种,-OH取代甲基上的H原子有2种结构;
④中甲基有2种,-OH取代甲基上的H原子有2种结构;
⑤中甲基有1种,-OH取代甲基上的H原子有1种结构;
故符合条件的C6H14O的同分异构体有8种,故选D.
点评 本题考查取代物限制条件同分异构体的判断,难度中等,根据等效氢原子,写出一取代物同分异构体,根据条件判断.一般说来,同一个碳原子上的氢原子等效,同一个碳原子上连的所有甲基上的氢原子等效,处于镜面对称位置上的氢原子等效.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.X、Y、Z、W四种短周期元素,原子序数依次增大.其中X的最外层电子数是最内层电子数的2倍,Y可形成双原子和三原子气体单质,Z和W形成的化合物中离子个数比为1:1,W的最高正价为+7价.则下列说法正确的是( )
| A. | Y形成的简单离子半径小于Z形成的简单离子半径 | |
| B. | X的氢化物稳定性弱于Y的氢化物稳定性 | |
| C. | 四种元素中,W的氧化物对应的水合物酸性最强 | |
| D. | Y与Z形成的两种化合物中所含有化学键类型相同 |
18.化学与生产、生活、社会密切相关,下列叙述错误的是( )
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
15.下列物质溶于水因水解而使溶液呈酸性的是( )
| A. | SO2 | B. | NaHSO3 | C. | CH3COONa | D. | FeCl2 |
2.下列物质性质与应用对应关系正确的是( )
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
19.下列说法正确的是( )
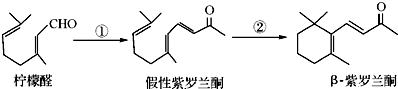
| A. | 按系统命名法,有机物 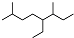 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的  最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |
 .
.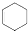 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基