题目内容
4.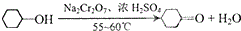 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表(括号中的数据表示该有机物与水形成的具有固定组成的 混合物的沸点.):
| 物质 | 沸点( ) | 密度(g.cm-3,20) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |
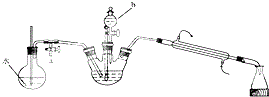
实验步骤如下:
①将重铬酸钠溶液与浓硫酸混合,冷却至室温备用;
②在三颈烧瓶中加入20.0环己醇,并将①中溶液分三次加入三颈烧瓶.控制温度在55℃~60℃之间,充分反应;
③打开活塞a.加热圆底烧瓶,当有大量水蒸气冲出时,关闭活塞a;
④向锥形瓶收集到的粗产品中加入NaCl固体至饱和,静置,分液;
⑤水层用乙醚萃取,萃取液并入有机层;
⑥有机层再加入无水MgSO4固体并过滤,取滤液蒸馏,先除去乙醚(乙醚沸点34.6℃,易燃烧),然后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)仪器b的名称是分液漏斗,步骤①的操作方法是将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌.
(2)将①中溶液分三次加入三颈瓶的原因是防止温度过高发生副反应.
(3)步骤③实验操作的目的是水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮,实验过程中要经常检查圆底烧瓶中玻璃管内的水位,当水位上升过高时,应立即进行的操作是打开活塞a.
(4)步骤④中分液时有机层在上(填“上”或“下”)层,蒸馏除乙醚的过程中最好采用的加热方式是水浴加热.
(5)本实验得环己酮12.0g,则环己酮的产率是61.2%.
分析 (1)由仪器结构特征,可知仪器b为分液漏斗;根据浓硫酸稀释操作进行解答;
(2)反应为放热反应,一次性加入会放出大量的热,温度过高会导致副反应发生;
(3)利用水蒸气与环己酮形成的具有固定组成的混合物,进行蒸馏出产品环己酮;圆底烧瓶中玻璃管内的水位上升过高时,说明装置内压强过大,应立即打开活塞a降低装置内压强;
(4)有机层的密度小于水,有机层在上层;乙醚以挥发,利用水浴加热进行蒸馏除去乙醚;
(5)根据环己醇的质量计算环己酮的理论产量,产率=(实际产量÷理论产量)×100%.
解答 解:(1)由仪器结构特征,可知仪器b为分液漏斗;重铬酸钠溶液与浓硫酸混合操作为:将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌,
故答案为:分液漏斗;将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌;
(2)反应为放热反应,一次性加入会放出大量的热,故应分多次加入,防止温度过高发生副反应,
故答案为:防止温度过高发生副反应;
(3)步骤③实验操作的目的是:水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮;圆底烧瓶中玻璃管内的水位上升过高时,说明装置内压强过大,应立即打开活塞a降低装置内压强,防止爆炸危险发生,
故答案为:水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮;打开活塞a;
(4)有机层的密度小于水,有机层在上层;乙醚以挥发,利用水浴加热进行蒸馏除去乙醚,
故答案为:上;水浴加热;
(5)环己酮的理论产量为20g×$\frac{98}{100}$=19.6g,故产率=(12g÷19.6g)×100%=61.2%,
故答案为:61.2.
点评 本题考查有机实验制备,涉及仪器识别、浓硫酸稀释、对装置与操作的分析评价、物质的分离提纯、产率计算等,难度中等,是对学生综合能力的考查.

练习册系列答案
相关题目
20.苯酚在一定条件下能与氢气加成得到环己醇.下面关于这两种有机物的叙述中,错误的是( )
| A. | 都能溶于水,但溶解性都比乙醇的差 | |
| B. | 都能与金属钠反应放出氢气 | |
| C. | 苯酚是比碳酸更强的酸,环己醇则显中性 | |
| D. | 苯酚与FeCl3溶液作用显紫色,环乙醇加入FeCl3溶液中无明显现象 |
18.将Mg、Cu组成的混合物13.2g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体4.48L(无其他还原产物),向反应后的溶液中加入过量的2.5mol•L-1的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
16. 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
根据实验数据求:
(1)实验完毕后,生成物中水的质量为1.8 g.假设广口瓶里生成一种正盐,其质量为5.0 g.
(2)生成的水中氢元素的质量为0.2 g.
(3)生成的CO2中碳元素的质量为0.6 g.
(4)气态化石燃料中碳元素与氢元素的质量比为3:1.
 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为1.8 g.假设广口瓶里生成一种正盐,其质量为5.0 g.
(2)生成的水中氢元素的质量为0.2 g.
(3)生成的CO2中碳元素的质量为0.6 g.
(4)气态化石燃料中碳元素与氢元素的质量比为3:1.
13.对下列有机反应类型的认识中,错误的是( )
| A. | 苯乙烯使溴水褪色;加成反应 | |
| B. | 乙烯水化生成乙醇;取代反应 | |
| C. | 乙醇与CuO加热反应生成乙醛;氧化反应 | |
| D. | 无水乙醇与浓硫酸加热到170℃制取乙烯;消去反应 |
14.可用于判断碳酸氢钠固体粉末中混有碳酸钠的实验方法是( )
| A. | 加热时无气体放出 | |
| B. | 溶于水后滴加稀BaCl2溶液有白色沉淀生成 | |
| C. | 滴加盐酸时有气泡放出 | |
| D. | 溶于水后滴加澄清石灰水有白色沉淀生成 |
 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):