题目内容
1. 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):(1)写出物质的化学式:BCl2MHClO
(2)写出A物质的电子式

(3)0.1mol/LE水溶液中各离子浓度由大到小的顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+)
(4)反应①的离子方程式Cl2+2OH-=Cl-+ClO-+H2O反应⑤的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(5)反应④中,若转移0.02mol电子后停止反应,溶液的体积是200mL,则此时溶液(不考虑电解产物的相互反应)的PH=13.
分析 A、E、F的焰色反应呈黄色,说明都含有钠元素,B、C、D、K在常温下都是气体单质,物质I的1个分子由4个原子组成并共含有10个电子,则I应为NH3,反应①~⑤都是用于工业生产的反应,则反应⑤应为氨的催化氧化,所以K为O2,G在常温下是无色液体,所以G为H2O,则J为NO,C、D为N2、H2中的一种,M在光照条件下生成氧气,应为次氯酸的见光分解,所以M为HClO,H为HCl,则B为Cl2,C为H2,D为N2,E为NaClO,F、G电解生成A、B、C,应为工业上电解饱和食盐水,所以A为NaOH,则F为NaCl,反应①为工业上用碱吸收氯气的反应,据此答题.
解答 解:A、E、F的焰色反应呈黄色,说明都含有钠元素,B、C、D、K在常温下都是气体单质,物质I的1个分子由4个原子组成并共含有10个电子,则I应为NH3,反应①~⑤都是用于工业生产的反应,则反应⑤应为氨的催化氧化,所以K为O2,G在常温下是无色液体,所以G为H2O,则J为NO,C、D为N2、H2中的一种,M在光照条件下生成氧气,应为次氯酸的见光分解,所以M为HClO,H为HCl,则B为Cl2,C为H2,D为N2,E为NaClO,F、G电解生成A、B、C,应为工业上电解饱和食盐水,所以A为NaOH,则F为NaCl,反应①为工业上用碱吸收氯气的反应,
(1)根据上面的分析可知,B为Cl2,M为HClO,
故答案为:Cl2;HClO;
(2)A为NaOH,其电子式为 ,
,
故答案为: ;
;
(3)E为NaClO,ClO-会发生水解,溶液呈碱性,所以0.1mol/LE水溶液中各离子浓度由大到小的顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+);
(4)反应①为工业上用碱吸收氯气的反应,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,反应⑤的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)电解食盐水的反应中,若转移0.02mol电子,可得0.02molOH-,溶液的体积是200mL,则此时溶液的c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液中PH=13,
故答案为:13.
点评 本题主要考查了氯、氮等元素及其化合物知识,中等难度,涉及电子式、离子浓度比较、离子方程式、pH值的计算等,物质推断是解题的关键,要学会根据特征反应及现象进行推断,要熟练掌握常见的反应在工业中的应用.

 考前必练系列答案
考前必练系列答案| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
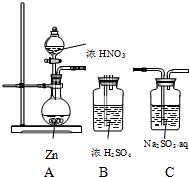 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:(1)该装置的明显缺陷是:无尾气处理装置
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+写出反应的离子方程式:4Zn+NO3-+10H+=4Zn2++NH4++3H2O 如何验证该猜想:取少量A中反应后的溶液置于试管中,向其中滴加少量氢氧化钠溶液,并加热,在试管口处放置一张湿润的红色石蕊试纸,若试纸变蓝,则猜想成立
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品意选择,合理即可)
| 步骤 | 现象 | 结论 |
| 取少量C中反应后的溶液 置于试管中, 先加入盐酸溶液酸化,再加入 氯化钡溶液 | 有白色沉淀产生 | NO2具有氧化性 |
假一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二是(“是”或“否”)合理,
理由:3NO2+H2O=2HNO3+NO(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:在一个真空密闭容器中同时通入NO2和SO2,一段时间后,容器中气体的红棕色褪去,证明了二者发生了反应,证明了NO2的氧化性.
MnO4-→Mn2+,Cl2→Cl-;Fe3+→Fe2+;HNO3→NO.如果将等物质的量的KI氧化成I2,所用物质的量浓度相同的四种溶液中体积最少的是( )
| A. | Cl2 | B. | Fe3+ | C. | HNO3 | D. | MnO4- |
| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0,若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现
(4)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ N2+2CO2.
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐.其吸收能力顺序如下:12MgO<2oCaO<38SrO<56BaO.原因是由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强.
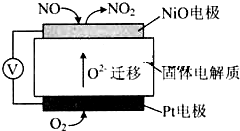
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
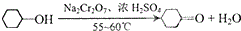 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表(括号中的数据表示该有机物与水形成的具有固定组成的 混合物的沸点.):
| 物质 | 沸点( ) | 密度(g.cm-3,20) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |
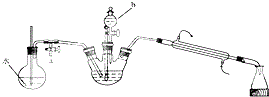
实验步骤如下:
①将重铬酸钠溶液与浓硫酸混合,冷却至室温备用;
②在三颈烧瓶中加入20.0环己醇,并将①中溶液分三次加入三颈烧瓶.控制温度在55℃~60℃之间,充分反应;
③打开活塞a.加热圆底烧瓶,当有大量水蒸气冲出时,关闭活塞a;
④向锥形瓶收集到的粗产品中加入NaCl固体至饱和,静置,分液;
⑤水层用乙醚萃取,萃取液并入有机层;
⑥有机层再加入无水MgSO4固体并过滤,取滤液蒸馏,先除去乙醚(乙醚沸点34.6℃,易燃烧),然后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)仪器b的名称是分液漏斗,步骤①的操作方法是将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌.
(2)将①中溶液分三次加入三颈瓶的原因是防止温度过高发生副反应.
(3)步骤③实验操作的目的是水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮,实验过程中要经常检查圆底烧瓶中玻璃管内的水位,当水位上升过高时,应立即进行的操作是打开活塞a.
(4)步骤④中分液时有机层在上(填“上”或“下”)层,蒸馏除乙醚的过程中最好采用的加热方式是水浴加热.
(5)本实验得环己酮12.0g,则环己酮的产率是61.2%.
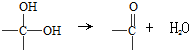
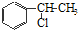 、
、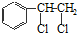 等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去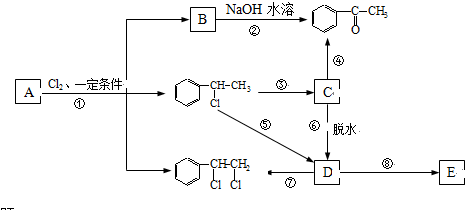
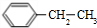 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$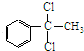 +2HCl,该反应类型为取代反应;
+2HCl,该反应类型为取代反应;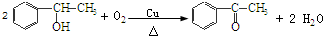 ,该反应类型为氧化反应;
,该反应类型为氧化反应;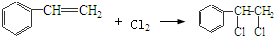 ,该反应类型为加成反应;
,该反应类型为加成反应;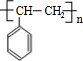 ;
;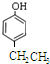 、
、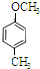 、
、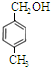 .
.