题目内容
14.可用于判断碳酸氢钠固体粉末中混有碳酸钠的实验方法是( )| A. | 加热时无气体放出 | |
| B. | 溶于水后滴加稀BaCl2溶液有白色沉淀生成 | |
| C. | 滴加盐酸时有气泡放出 | |
| D. | 溶于水后滴加澄清石灰水有白色沉淀生成 |
分析 A.碳酸氢钠较不稳定,受热易分解;碳酸钠较稳定,受热不易分解;
B.碳酸氢钠和氯化钡不符合复分解反应条件;碳酸钠和氯化钡符合复分解反应条件;
C.二者都与稀盐酸反应生成二氧化碳气体;
D.二者都能和氢氧化钙反应生成白色沉淀.
解答 解:A.加热时,碳酸氢钠分解放出气体,碳酸钠温度不分解,可以采用加热法检验碳酸氢钠,故A错误;
B.只有碳酸钠与氯化钡反应生成白色沉淀,碳酸氢钠和氯化钡不反应,所以可以鉴别,故B正确;
C.碳酸钠和碳酸氢钠与盐酸都反应生成气体,二者反应现象相同,所以不能鉴别,故C错误;
D.碳酸钠和碳酸氢钠溶于水后滴加澄清石灰水都有白色沉淀生成,反应现象相同,不能用澄清石灰水鉴别,故D错误;
故选B.
点评 本题考查无机物鉴别,侧重考查元素化合物知识,明确物质的性质及物质性质的差异性是解本题关键,难点是检验试剂或方法的选取,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.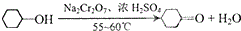 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
环己醇、环己酮和水的部分物理性质见下表(括号中的数据表示该有机物与水形成的具有固定组成的 混合物的沸点.):
实验装置如图所示:
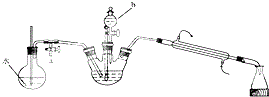
实验步骤如下:
①将重铬酸钠溶液与浓硫酸混合,冷却至室温备用;
②在三颈烧瓶中加入20.0环己醇,并将①中溶液分三次加入三颈烧瓶.控制温度在55℃~60℃之间,充分反应;
③打开活塞a.加热圆底烧瓶,当有大量水蒸气冲出时,关闭活塞a;
④向锥形瓶收集到的粗产品中加入NaCl固体至饱和,静置,分液;
⑤水层用乙醚萃取,萃取液并入有机层;
⑥有机层再加入无水MgSO4固体并过滤,取滤液蒸馏,先除去乙醚(乙醚沸点34.6℃,易燃烧),然后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)仪器b的名称是分液漏斗,步骤①的操作方法是将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌.
(2)将①中溶液分三次加入三颈瓶的原因是防止温度过高发生副反应.
(3)步骤③实验操作的目的是水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮,实验过程中要经常检查圆底烧瓶中玻璃管内的水位,当水位上升过高时,应立即进行的操作是打开活塞a.
(4)步骤④中分液时有机层在上(填“上”或“下”)层,蒸馏除乙醚的过程中最好采用的加热方式是水浴加热.
(5)本实验得环己酮12.0g,则环己酮的产率是61.2%.
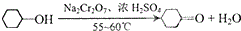 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表(括号中的数据表示该有机物与水形成的具有固定组成的 混合物的沸点.):
| 物质 | 沸点( ) | 密度(g.cm-3,20) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |

实验步骤如下:
①将重铬酸钠溶液与浓硫酸混合,冷却至室温备用;
②在三颈烧瓶中加入20.0环己醇,并将①中溶液分三次加入三颈烧瓶.控制温度在55℃~60℃之间,充分反应;
③打开活塞a.加热圆底烧瓶,当有大量水蒸气冲出时,关闭活塞a;
④向锥形瓶收集到的粗产品中加入NaCl固体至饱和,静置,分液;
⑤水层用乙醚萃取,萃取液并入有机层;
⑥有机层再加入无水MgSO4固体并过滤,取滤液蒸馏,先除去乙醚(乙醚沸点34.6℃,易燃烧),然后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)仪器b的名称是分液漏斗,步骤①的操作方法是将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌.
(2)将①中溶液分三次加入三颈瓶的原因是防止温度过高发生副反应.
(3)步骤③实验操作的目的是水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮,实验过程中要经常检查圆底烧瓶中玻璃管内的水位,当水位上升过高时,应立即进行的操作是打开活塞a.
(4)步骤④中分液时有机层在上(填“上”或“下”)层,蒸馏除乙醚的过程中最好采用的加热方式是水浴加热.
(5)本实验得环己酮12.0g,则环己酮的产率是61.2%.
19.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
| A. | 盐酸、空气、醋酸、干冰 | B. | 铁、海水、硫酸钠、乙醇 | ||
| C. | 硫酸、蔗糖、烧碱、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
6.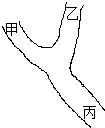 “Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
“Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
 “Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
“Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )| A. | ①和⑥ | B. | ①③⑥ | C. | ①③④⑥ | D. | ①②③④⑤⑥ |
3.下列化学用语使用正确的是( )
| A. | 乙烯的球棍模型为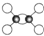 | |
| B. | H2O2的电子式为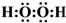 | |
| C. | 甲烷的结构式为CH4 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3CH2 |
4.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 1 mol 铁加入到足量的该硫酸中,可产生2 g H2 | |
| C. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol•L-1 | |
| D. | 配制200 mL 4.6 mol•L-1的硫酸溶液需取该硫酸50 mL |
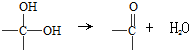
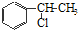 、
、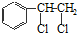 等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去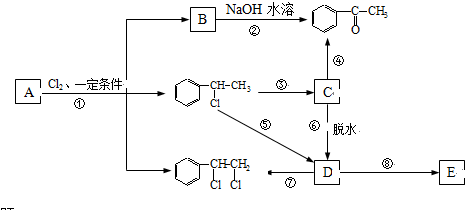
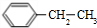 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$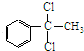 +2HCl,该反应类型为取代反应;
+2HCl,该反应类型为取代反应;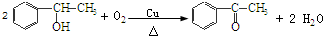 ,该反应类型为氧化反应;
,该反应类型为氧化反应;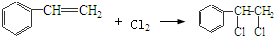 ,该反应类型为加成反应;
,该反应类型为加成反应;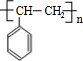 ;
;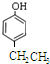 、
、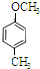 、
、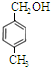 .
.