题目内容
20.下列说法中正确的是( )| A. | 1 mol Al3+含有的核外电子数为3×6.02×1023 | |
| B. | 将58.5 g NaCl溶于1.00 L水中,所得NaCl溶液的浓度为1.00 mol•L-1 | |
| C. | 2 mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 | |
| D. | 常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
分析 A.1 mol Al3+含有10mol电子;
B.58.5 g NaCl为1mol,溶于水配成1.00 L溶液,所得NaCl溶液的浓度为1.00 mol•L-1;
C.SO2与O2反应生成SO3,反应属于可逆反应,SO2不能完全反应;
D.pH=1的硫酸溶液中含有的H+离子浓度为0.1mol/L,根据n=cV计算H+离子物质的量,再根据N=nNA计算.
解答 解:A.1 mol Al3+含有10mol电子,故含有电子数目为10×6.02×1023,故A错误;
B.58.5 g NaCl为1mol,溶于水配成1.00 L溶液,所得NaCl溶液的浓度为1.00 mol•L-1,体积1L为溶液体积,不是溶剂体积,故B错误;
C.SO2与O2反应生成SO3,反应属于可逆反应,SO2不能完全反应,转移的电子数小于4×6.02×1023,故C错误;
D.pH=1的硫酸溶液中含有的H+离子浓度为0.1mol/L,100mL溶液中H+离子物质的量为0.1L×0.1mol/L=0.01mol,溶液中含有的H+离子数为0.01×6.02×1023,故D正确,
故选D.
点评 本题考查物质的量有关计算,注意C选项中可逆反应的不完全性,难度不大.

练习册系列答案
相关题目
8.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 18 g H2O中所含的电子总数为10NA个 | |
| B. | 1 L 1 mol•L-1的盐酸中含有的HCl分子数为NA个 | |
| C. | 1 mol I2晶体完全升华后所得气体的体积约为22.4 L | |
| D. | 常温下78 g Na2O2中含有O2-的数目为2NA个 |
15.下列叙述中正确的是( )
| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
5.随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现.下列有关说法中,正确的是( )
| A. | N5+离子中含有36个电子 | B. | O2与O4属于同位素 | ||
| C. | C60是有机物 | D. | H2与H3属于同种元素组成的单质 |
12.下列说法正确的是( )
| A. | 盐酸、氨气和碳酸钠都是电解质 | |
| B. | 常温常压下,22.4L CO2气体的物质的量大于1mol | |
| C. | 2.4克石墨和C60的混合物所含碳原子数约为0.2×6.02×1023 | |
| D. | 氢氧化铁胶体较稳定,是因为该胶体带有正电荷 |
9.在一定体积和一定条件下有反应N2+3H2?2NH3,现分别从两条途径建立平衡:
Ⅰ.起始浓度 N2:l mol•L -1,H2:3mol•L -1
Ⅱ.起始浓度 N2:2mol•L -1,H2:6mol•L -1
则下列叙述正确的是( )
Ⅰ.起始浓度 N2:l mol•L -1,H2:3mol•L -1
Ⅱ.起始浓度 N2:2mol•L -1,H2:6mol•L -1
则下列叙述正确的是( )
| A. | Ⅰ和II两途径达到平衡时,体系内各成分的体积分数相同 | |
| B. | 达到平衡时,Ⅰ途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2) | |
| C. | 达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍 | |
| D. | 达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的$\frac{1}{2}$ |
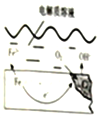 如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈
如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈 ,写出水分子的电子式
,写出水分子的电子式 .
.