题目内容
15.下列叙述中正确的是( )| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
分析 A、P4是单质;
B、CaO是离子晶体构成微粒阴阳离子和SiO2是原子晶体,构成微粒是原子;
C、四氯化碳是极键形成的非极性分子;
D、甲烷是对称的正四面体结构.
解答 解:A、P4是单质,不是化合物,故A错误;
B、CaO是离子晶体构成微粒阴阳离子和SiO2是原子晶体,构成微粒是原子,所以不存在单个小分子,故B正确;
C、四氯化碳是极键形成的非极性分子,而NH3是以极性键结合的极性分子,故C错误;
D、甲烷是对称的正四面体结构,而不是平面结构,故D错误;
故选B.
点评 本题考查了知识点较综合,涉及化学键、晶体类型的判断、空间构型的判断等知识点,难度较大,易错点是微粒空间构型的判断、分子极性的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列关于元素周期表与化学键的知识叙述错误的是( )
| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
3.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)上述元素中,化学性质最不活泼的是Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是 .
.
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是
 .
.(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
10.下列物质中既含有非极性键,又含有极性键的是( )
| A. | CH4 | B. | Na2O2 | C. | C2H5OH | D. | H2O |
20.下列说法中正确的是( )
| A. | 1 mol Al3+含有的核外电子数为3×6.02×1023 | |
| B. | 将58.5 g NaCl溶于1.00 L水中,所得NaCl溶液的浓度为1.00 mol•L-1 | |
| C. | 2 mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 | |
| D. | 常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol Na2O2 中有4 NA个离子 | |
| B. | 常温常压下,11.2L氧气所含的原子数为NA | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
4.用NA表示阿伏加德罗常数的数值.下列叙述中正确的是( )
| A. | 1molC2H6O中含有C-C键的数目一定为NA | |
| B. | 25℃,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA | |
| C. | 标准状况下,2.24L异丁烷含有的分子数目为0.1NA | |
| D. | 常温常压下,0.3molNO2与足量H2O充分反应,转移电子的数目为0.3NA |
5.下列说法正确的是( )
| A. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| B. | 将8.0gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为0.2mol/L | |
| C. | 阿伏加德罗常数个H2O分子在标准状况下的体积是22.4L | |
| D. | 在标准状况下,20mLNH3与60mLO2所含的分子个数比为1:3 |
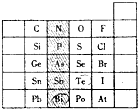 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.