题目内容
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)
【答案】(1)②(2)7.35%
【解析】
(1)通过分析表中的数据可知,实验②反应后,溶液的pH值等于7,两者恰好完全反应,所以应该选择实验序号②的数据;故填:②。
(2)解:设与40g15%的氢氧化钠溶液反应的硫酸的溶质质量为x。
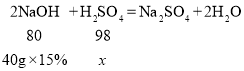
![]()
x=7.35g
残余硫酸的溶质质量分数为= ![]() ×100%=7.35%
×100%=7.35%
答:该残余硫酸的溶质质量分数7.35%。

练习册系列答案
相关题目