题目内容
【题目】在Ba(OH)2溶液中逐滴加入稀硫酸,变化的某些“量”与稀硫酸质量变化关系正确的是
A.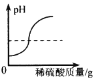 B.
B.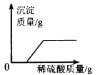
C.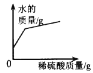 D.
D.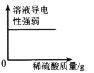
【答案】C
【解析】
A. H2SO4+Ba(OH)2=BaSO4↓+2H2O,Ba(OH)2溶液显碱性,pH>7;稀硫酸显酸性,pH<7;图像的起点位置应该从大于7开始,此选项错误;
B. 加入稀硫酸,稀硫酸立即与Ba(OH)2溶液反应产生白色沉淀,当Ba(OH)2溶液反应完以后,沉淀质量不再增大,图像的起点位置应该从原点开始,此选项错误;
C. Ba(OH)2溶液中含有一定量的水,加入稀硫酸后,由于稀硫酸中含有水,并且生成了水,所以水的质量增多,当Ba(OH)2溶液完全反应后,加入稀硫酸,增加水的质量只是稀硫酸中水的质量,没有生成的水,增加水的质量减少,此选项正确;
D. Ba(OH)2溶液能导电,稀硫酸也能导电,Ba(OH)2溶液与稀硫酸反应生成硫酸钡沉淀和水,硫酸钡不导电、水不导电,所以加入稀硫酸后导电性减弱,当Ba(OH)2溶液与稀硫酸恰好反应时,导电性为零,再加入稀硫酸,由于稀硫酸能导电,所以导电性又增强,此选项错误。
故选C。

【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)
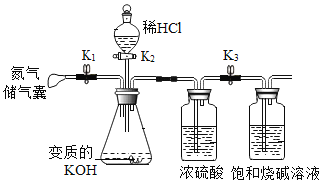
【题目】氢氧化钾是工业强碱之一,与氢氧化钠化学性质相似。一次化学实验后同学忘记盖瓶塞。化学兴趣小组同学想探究该瓶氢氧化钾固体是否变质。大家展开充分讨论,邀你参与。
(猜想)A、没有变质
B、部分变质
C、完全变质
(1)氢氧化钾在空气中变质的原因____(用方程式表示)。
(査阅资料)氯化钾溶液和氯化钙溶液呈中性。
(2)设计甲、乙两组实验方案并完成实验取瓶中固体少许,加水溶解配成溶液,分装于两支洁净试管。
实验方案 | 实验操作 | 实验现象 | 实验结论 |
甲 | 取一支试管,滴入无色酚酞试液,振荡 | 溶液变红色 | 猜想A正确 |
乙 | 取另一支试管,滴入足量的氯化钙溶液充分反应后再滴入几滴硫酸铵试液 | 先有___产生 再有____产生 | 猜想B正确 |
(3)(相互交流)大家认为甲的方案不可信,请你说出理由_____。滴入硫酸铵后发生的化学反应方程式_____。
(4)如果B猜想是正确的,大家想继续探究该瓶氢氧化钾固体中KOH的质量分数。设计了下列实验。
(操作步骤)①首先称量出饱和烧碱溶液(含仪器)的质量m1再与前面装置连接。
②按正确方法检查装置气密性,气密性良好。
③关闭K2,打开K1和K3,挤压N2储气囊给装置充分充气。
④关闭K1,打开K2滴入足量稀HCl,充分反应。⑤关闭K2,打开K1再次挤压N2储气囊,给装置充分充气。⑥关闭K3取下盛装烧碱的装置,称量质量为m2。回答问题:
(Ⅰ)步骤③充入N2的目是_____。
(Ⅱ)浓硫酸的作用是_______。
(Ⅲ)若不进行步骤⑤,KOH质量分数(偏大或偏小)____。