题目内容
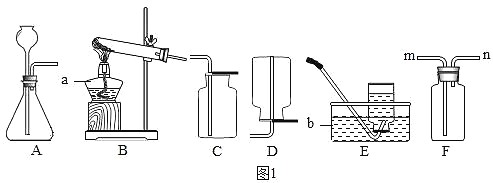
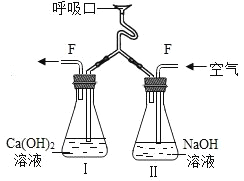
【题目】为了证明人呼出的气体中CO2含量大于空气中CO2含量,小明设计了下图所示装置。
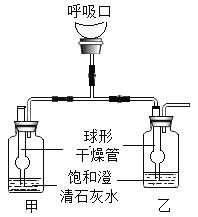
(1)乙装置中球形干燥管的作用是_____。
(2)经多次呼吸操作后,能说明人呼出的气体中 CO2含量大于空气中CO2含量的实验现象是_______________________________________。
(3)装置中产生上述实验现象的原因是_________( 用化学方程式表示)。
【答案】防倒吸作用; 乙装置中澄清石灰水变浑浊; Ca(OH)2+CO2=CaCO3↓+H2O。
【解析】
本实验采用的是控制变量法,瓶甲和瓶乙中装入相同饱和澄清石灰水。呼气时,保持乙瓶管道通气顺畅,夹闭甲瓶通气管道;吸气时,则相反。二氧化碳可使澄清石灰水变浑,呼气时,二氧化碳含量较高,乙瓶中出现气泡,液体变浑浊,而甲瓶内澄清石灰水未明显变浑,通过瓶甲和瓶乙中不同的现象,可证明人体呼出的气体中二氧化碳含量明显高于空气中二氧化碳的含量。
(1)呼气时,二氧化碳含量较高,其会与瓶乙中饱和澄清石灰水发生反应导致接触面以上一段导管内气体压强急剧减小,外界大气压相对的就很大,澄清石灰水会倒流入导管中,此时球形干燥管就会起到很好的防倒吸作用;
(2)二氧化碳可使澄清石灰水变浑,呼气时,二氧化碳含量较高,乙瓶中出现气泡,澄清石灰水变浑浊,而甲瓶内澄清石灰水未明显变浑,通过瓶甲和瓶乙中不同的现象,可证明人体呼出的气体中二氧化碳含量明显高于空气中二氧化碳的含量。
(3)装置中产生上述实验现象是由于二氧化碳和饱和澄清石灰水发生反应,其化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O。

【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)