题目内容
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
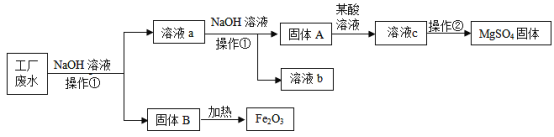
回答下列问题:
(1)操作①的名称是_____________,操作②时,当___________________时,即可停止加热。
(2)写出固体A与某酸溶液反应的化学方程式为________________。
(3)固体B加热的产物是两种常见氧化物,写出该反应的化学方程式为:________。
(4)溶液b除了可能含有NaOH外,还一定含有的溶质是___________(填化学式)。
【答案】过滤 出现较多固体 ![]()
![]() NaCl、Na2SO4
NaCl、Na2SO4
【解析】
(1)由图可知,操作①实现了固液分离,故操作①是过滤;
溶液c经过操作②变为硫酸镁固体,故操作②是蒸发,蒸发过程中,当出现较多固体时,即可停止加热;
(2)由图可知,固体A加酸变成溶液c,溶液c蒸发得到硫酸镁固体,故溶液c是硫酸镁溶液,故固体A为硫酸镁与氢氧化钠反应生成的氢氧化镁沉淀,加入的酸为硫酸,氢氧化镁与硫酸反应生成硫酸镁和水,该反应的化学方程式为:![]() ;
;
(3)由图可知,固体B为加入氢氧化钠后形成,且固体B加热可得氧化铁,故固体B为氯化铁与氢氧化钠反应生成的氢氧化铁,氢氧化铁加热生成氧化铁和另一种氧化物,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含铁、氢、氧,故生成的另一氧化物是水,该反应的化学方程式为:![]() ;
;
(4)由图及以上分析可知,废液中加入氢氧化钠,氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,故溶液a中可能含有氯化钠、硫酸镁,再加入氢氧化钠,硫酸镁与氢氧化钠反应生成氢氧化镁和硫酸钠,故溶液b中除了可能含有NaOH外,还一定含有的溶质是NaCl、Na2SO4。

【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)
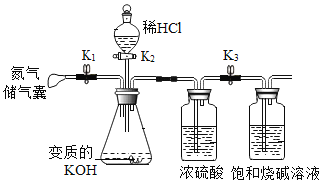
【题目】氢氧化钾是工业强碱之一,与氢氧化钠化学性质相似。一次化学实验后同学忘记盖瓶塞。化学兴趣小组同学想探究该瓶氢氧化钾固体是否变质。大家展开充分讨论,邀你参与。
(猜想)A、没有变质
B、部分变质
C、完全变质
(1)氢氧化钾在空气中变质的原因____(用方程式表示)。
(査阅资料)氯化钾溶液和氯化钙溶液呈中性。
(2)设计甲、乙两组实验方案并完成实验取瓶中固体少许,加水溶解配成溶液,分装于两支洁净试管。
实验方案 | 实验操作 | 实验现象 | 实验结论 |
甲 | 取一支试管,滴入无色酚酞试液,振荡 | 溶液变红色 | 猜想A正确 |
乙 | 取另一支试管,滴入足量的氯化钙溶液充分反应后再滴入几滴硫酸铵试液 | 先有___产生 再有____产生 | 猜想B正确 |
(3)(相互交流)大家认为甲的方案不可信,请你说出理由_____。滴入硫酸铵后发生的化学反应方程式_____。
(4)如果B猜想是正确的,大家想继续探究该瓶氢氧化钾固体中KOH的质量分数。设计了下列实验。
(操作步骤)①首先称量出饱和烧碱溶液(含仪器)的质量m1再与前面装置连接。
②按正确方法检查装置气密性,气密性良好。
③关闭K2,打开K1和K3,挤压N2储气囊给装置充分充气。
④关闭K1,打开K2滴入足量稀HCl,充分反应。⑤关闭K2,打开K1再次挤压N2储气囊,给装置充分充气。⑥关闭K3取下盛装烧碱的装置,称量质量为m2。回答问题:
(Ⅰ)步骤③充入N2的目是_____。
(Ⅱ)浓硫酸的作用是_______。
(Ⅲ)若不进行步骤⑤,KOH质量分数(偏大或偏小)____。
【题目】啤酒盖(主要成分为铁)生锈直接影响啤酒厂家的市场销售和品牌形象。某小组同学用铁钉代替啤酒盖模拟其生锈实验,探究铁生锈的条件及影响生锈速率的因素。
I.探究铁生锈的条件
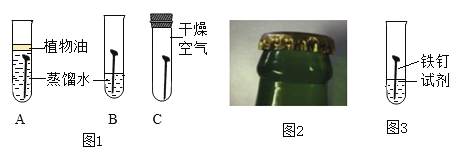
(1)证明铁生锈需要与氧气接触的实验现象是____________。
Ⅱ.探究影响铁生锈速率的因素
(查阅资料)啤酒的pH值大约在3.8~4.6之间。
(猜想假设)铁钉生锈可能与溶液酸碱度、温度、是否杀菌有关。
实验1
分别取铁钉浸于等体积液体中,在空气中放置相同时间进行如下实验:
实验 | 是否杀菌 | pH值 | 温度/℃ | 锈蚀情况/% |
1 | 杀菌 | 6 | 20 | 无现象 |
2 | 杀菌 | 6 | 70 | 较明显生锈 |
3 | 未杀菌 | 6 | 70 | 明显生锈 |
4 | 未杀菌 | 6 | 20 | 略微生锈 |
实验2
在70℃时,将杀菌后的铁钉于等体积溶液中,在空气中放置相同时间进行如下实验:
实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
pH值 | 5 | 7 | 9 | 11 | |
锈蚀情况 | 完全生锈 | 明显生锈 | 略微生锈 | 无现象 | 无现象 |
(解释与结论):
(2)由实验1得出“温度与铁生锈速率有关”的结论,依据的两个实验是___________(填编号)。
(3)实验2的目的是____________。
(4)由实验1和实验2推知影响铁生锈的因素是______________。
(5)实验2没有进行pH=13的实验,理由是______________。
(6)结合本题请分析啤酒盖易生锈的原因是_____________。
(反思与评价)
如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):

(1)甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果.乙同学不同意他的观点,认为必须全面观察试管____________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论.
(2)试管D和E实验的目的是_____________的环境中是否更容易锈蚀.
(3)通过本次探究活动,你有哪些收获和体会?______________