题目内容
【题目】甲、乙两种固体(不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )
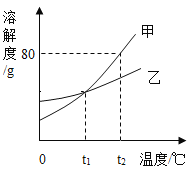
A.乙中含有少量甲时,可用降温结晶法提纯乙
B.t2℃时的甲、乙饱和溶液分别降温到t1℃时,析出晶体的质量甲大于乙
C.t2℃时,将50g甲加入50g水中,可得到100g溶液
D.t1℃时,甲、乙饱和溶液溶质的质量分数相等
【答案】D
【解析】
A. 乙的溶解度受温度影响变大,对于溶解度受温度影响不大的物质,采用蒸发结晶法,使溶质从溶液中结晶析出,此选项错误;
B. 甲的溶解度受温度影响比乙大,t2℃时,等质量的甲、乙饱和溶液分别降温到t1℃时,析出晶体的质量甲大于乙,此选项错误;
C. t2℃时,甲的溶解度为80g,将50g甲加入50g水中,可得到40g+50g=90g溶液,此选项错误;
D. t1℃时,甲、乙的溶解度相等,甲、乙饱和溶液溶质的质量分数相等,此选项正确。
故选D。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)