题目内容
【题目】有一包固体粉末,可能含有Na2CO3、FeCl3、NH4Cl、NaCl中的一种或多种。根据下列实验回答问题:
(1)取少量固体粉末与熟石灰研磨,无氨味。由此判断:原固体粉末中一定不含_______________。
(2)另取少量固体粉末进行如下实验:
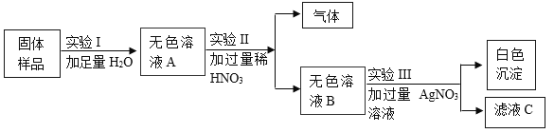
①由实验Ⅰ判断:原固体粉末中一定不含__________________。
②由实验Ⅱ、Ⅲ判断:原固体粉末中一定含有__________________。
③实验Ⅲ中生成白色沉淀的化学方程式为__________________。
【答案】NH4C1 FeCl3 Na2CO3、NaCl ![]()
【解析】
(1)氯化铵和熟石灰反应生成氯化钙氨气和水,取少量固体粉末与熟石灰研磨,无氨味,说明不含氯化铵,故填:NH4Cl。
(2)氯化铁溶解溶液呈黄色,溶液无色说明不含FeCl3故填:FeCl3。
(3)只有碳酸钠和硝酸反应能生成气体,生成气体说明含碳酸钠,硝酸过量反应后溶液中不含碳酸钠,氯化钠和硝酸银生成氯化银沉淀和硝酸钠,加入硝酸银产生沉淀说明含氯化钠,故一定含Na2CO3、NaCl,故填:Na2CO3、NaCl。
(4)氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为![]() ,故填:
,故填:![]() 。
。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据见下表
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的PH值 |
① | 30g | pH>7 |
② | 40g | pH=7 |
③ | 50g | pH<7 |
请回答下列问题:
(1)计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号______的数据
(2)若该定量石油产品残余硫酸的质量为100g,计算该残余硫酸的溶质质量分数(写出详细的计算过程)