��Ŀ����
����Ŀ��ij��ѧ��ȤС��ͨ��̽���ѧϰ�����⻯ѧ֪ʶ������һ���о�ѧϰ�����ش��й����⣮
�о����⣺ˮ��Һ�и��ֽⷴӦ��ʵ��
�����Ϣ��һ���������Һ�У����ӵ���ĿԽ�࣬�����ӵ�Ũ��Խ�絼�ʴ��������ڲ�����Һ�ĵ�����ǿ�����ܷ�ӳ����Ũ�ȴ�С����ͬ�¶���ͬ����Һ�絼��Խ������Ũ��Խ��
(1)ʵ��һ�����������£���100mLһ��Ũ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡ���ᣬ�����Һ�ĵ絼�ʱ仯��ͼ�м�������ʾ��
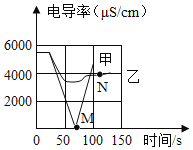
�ټ�����M��ʱ���Һ���_____ɫ��
��ͨ���Լ����ߵķ���������˵���������_____������ţ���
a��M��ǰ�����»��Ĺ����У�H+��OH����ϳ�H2O��Ba2+��SO42����ϳ�BaSO4
b��M��ʱ����Ũ�ȼ���Ϊ��
c��M�����Һ�絼��������������Һ��H+��������
�۾��ⶨ��M��ʱ����ϡH2SO4��Һ50mL���ҹ��˺���Һ����Ϊ147. 67g�������ԭBa(OH)2��Һ��������������_____ (д��������̣�����ϡ��Һ���ܶȶ��ɿ���1g��mL-1)��
(2)ʵ��������������£���100mLͬŨ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡNa2SO4��Һ�������Һ�ĵ絼�ʱ仯����ͼ��������ʾ��
��ͨ���������ߵķ���������˵���������_____������ţ���
a����ʼ����ȫ��Ӧ�����У��絼�ʼ�С����Һ�ɺ�ɫ��Ϊ��ɫ
b���絼���½�����͵�ʱ��Ȼ�ϴ�����Һ�л����ڽ϶�����
c������ʵ������У���Һ��Na+��Ŀһֱ����
��N��ʱ����Һ�к��е�������______________�������ӷ��ţ���
��ͨ���ȽϷ����������ѧ֪ʶ��֪����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ��������Ũ��_____������������������С������
���𰸡��� C 1.71% A ![]() ��
��![]() ��SO42- ��С
��SO42- ��С
��������
��1����������M��ʱ��Һ�ĵ絼��Ϊ0��֤������ǡ����ȫ��Ӧ����Һ�����ԣ���̪��Һ������������Ϊ��ɫ��
�ʴ𰸣���
��a��M��ǰ�����»��Ĺ����У�������������������������ϡ���ᷴӦ�������ᱵ������ˮ��ʵ��Ϊ�����Ӻ����������ӽ�ϳ�ˮ�������Ӻ���������ӽ�ϳ����ᱵ��������a��ȷ��
b.M��ʱ����ǡ����ȫ��Ӧ����Һ��ֻ����ˮ����������������Ӻ����������ӣ�����Ũ�ȼ���Ϊ�㣬��b��ȷ��
c.��M���������Һ��������Һ�ĵ絼����������������Һ����������������������Һ�������������������c����
�ʴ𰸣�c.
��![]() ������
������![]()
�⣺��![]() ������Ϊx��
������Ϊx��
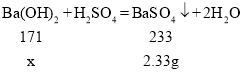
![]()
X=1.71g
![]() ����������
����������![]()
��ԭBa(OH)2��Һ��������������Ϊ1.71%��
��2���������������������Ʒ�����Ӧ�������ᱵ�������������ƣ����ɵ���������Ϊ���ӻ��������ˮ�н���������Ӻ����������ӡ�
a.��ʼ����ȫ��Ӧ�����У��絼�ʼ�С�����������Ƴʼ��ԣ���̪��Һ�ڼ���������Ϊ��ɫ����a����
b.�絼���½�����͵�ʱ��Ȼ�ϴ�����Һ�л����ڽ϶����ӣ���b��ȷ��
c.����ʵ������У�����������һֱ���������Һ�У���Һ����������Ŀһֱ����c��ȷ��
�ʴ𰸣�a
����N��ʱ����Һ�к����������ƺ����������ƣ��ʺ��е�������![]() ��
��![]() ��
��![]() ��
��
�ʴ𰸣�![]() ��
��![]() ��
��![]()
����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ������ת��ɲ�����Һ�в������ӵ����ʣ�������Ũ�ȼ�С��
�ʴ𰸣���С

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ͬѧ�Ƿ�����һ�����������װ����������Һ��(�е�Ϊ-196��)�����Ĵ�����������������õ�����������ͼ��ʾʵ�飬ȴ��������δϨ��
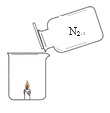
���������ϣ������ܶ���С�ڿ�����ѹǿ����ʱ�������¶�Խ�ͣ��ܶ�Խ��
(1)��ϵ������ʷ�������ͼ����δϨ���ԭ�������_______��
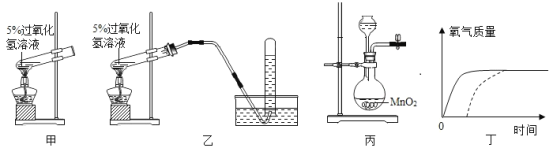
ʵ��1��̽�������ܷ��������(����������Ϊ���Ȳ��ϣ���ͬ)
ʵ���� | 1-1 | 1-2 | 1-3 |
ʵ������ |
|
|
|
ʵ������ | �������ȼ�� | ������Ϩ�� | ����Ϩ�� |
(2)ʵ��ǰ��ͬѧ�������Һ�����������ĵ����¶ȵͣ��ܶ��㹻������������ ����ȼ����Χ������������ʵ��1�жϣ����ּ���_____(����������������������)��
(3)��ͬѧ����ʵ��1����¼��裬�������������ȼ����Χ�����ĺ����йء��� ��֧����һ�����ʵ��������_______(��ʵ��1�е�ʵ����)��
ʵ��2��̽������뵪�������Ƿ��й�
ʵ���� | 2-1 | 2-2 | 2-3 |
ʵ������ |
|
|
|
ʵ������ | ����û��Ϩ�� | ������Ϩ�� |
(4)ʵ��2�У���������λ�õ���������ߵ���_________(��ʵ����)��
(5)�Ʋ�ʵ��2-3��������________��
(6)��˼ʵ��2�������������⣬Ӱ������ȼ�յ���������������________��
(7)�������ʵ�飬���й��� ���������װ����ʹ�õ�˵���У���������______(����ĸ���)��
A. �Ӹߴ���ʹ�����ʹ��
B. ��ȼ�����Ϩ��������ͨ��һ��ʱ��
C. �������������ڵķ�տռ���ʹ��ʱ��Ч�����ڿ��ſռ�
����Ŀ��ʵ��������ƿ���ܲ������Լ�����ͼ1������ƿ��ȱ�ı�ǩ��ֻʣ����Na������10%����������֪����NaCl��NaOH��Na2CO3��NaHCO3�е�һ�֣���ƿ�dz��ڷ��õ�30%��NaOH��Һ��ͬѧ�Ǻܸ���Ȥ����������ɷֽ���̽����

��ͬѧ����ƿ��ǩ��ȱ����Һչ���о���
��������⣩��ƿ�Լ�������ʲô��Һ�أ�
���������ۣ����������ǩ������жϣ���ƿ�Լ���������_____��������ĸ��
A �� B �� C ��
���������ϣ�
��Na2CO3��NaHCO3��Һ���ʼ��ԡ�
�ڲⶨ���£�20�棩ʱ���������ʵ��ܽ�ȵ���������
���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
�ܽ��g | 36 | 109 | 215 | 9.6 |
���ó����ۣ������Լ�ƿ��ע��������������10%���ϱ��е��ܽ�ȵ������жϣ���ƿ�Լ���������_____��
�����ʵ�鲢����̽����
��1���ýྻ�IJ�����պȡ����Һ����pH��ֽ�ϣ����pH��7����ƿ�Լ���������_____��
��2��Ϊ�˼������Һ��NaOH��Һ����Na2CO3��Һ�����ֽ���������ʵ�飺
�������� | ʵ������ | ���ۼ���ѧ����ʽ |
ȡ�����Թ��У��μ������� _____ | �����ݲ��� | ����Һ��_____ ��صĻ�ѧ����ʽ_____ |
����ͬѧ����ƿ���ڷ��õ���Һչ���о���
��1����ͬѧ�����������ƹ��弰��Һ�ڿ����к���������������̼���ƣ���������������������̽����
����������裩������������Һ�Ѳ��ֱ��ʡ�����������Һ���ʵķ�Ӧ����ʽ��_____��
��ʵ������ۣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
a��ȡ��������Һ��һ֧�Թ��У���������_____ | �а�ɫ�������� | ������������Һ�ѱ��� |
b��������a���õ�Һ�徲�ã�ȡ�ϲ���Һ����һ֧�Թ��У��μ�_____ /td> | _____ | ������������Һ�Ѳ��ֱ��� |
ʵ�鲽��a�м�����Լ�����������ԭ���ǣ�
����չ̽������ͬѧ�ֳ���ͨ��ʵ���ȥ������������Һ�к��е�̼���ƣ��������£�
�����Һ�м���������_____��Һ����ַ�Ӧ��_____���������ɳ�ȥ������������Һ�к��е����ʡ�
��ͬѧ�������ϵ�֪��̼������ϡ���ᷴӦ���������У�Na2CO3+HCl��NaHCO3+NaCl��NaHCO3+HCl��NaCl+H2O+CO2������ȡ14.6g���ʵ��������ƹ�����Ʒ������ˮ������ƿ�У�����50.0gˮ������ܽ⣬������ƿ�еμӵ�������������Ϊ7.3%��ϡ���ᡣʵ���ü���ϡ�������������ƿ�����ʵ���������ϵ��ͼ2��ʾ������˵����ȷ����_____��
A N�����Һ��ʾ�������Ʊ�ǡ����ȫ��Ӧ
B PQ�Σ�����P�㣩��Һ��pH��7
C NP�α�ʾ��������Ĺ��̣�a��ֵΪ210.2
D �ù�����Ʒ���������Ƶ�����Ϊ8.0g��