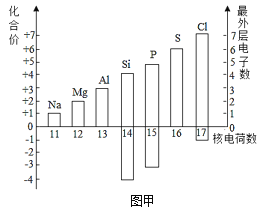
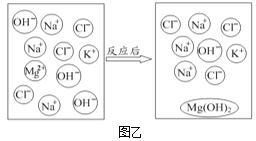
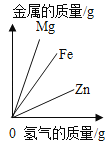
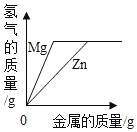
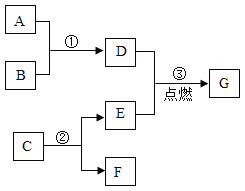
题目内容
【题目】如图是甲、乙两种固体物质的溶解度曲线.
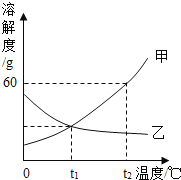
(1)溶解度随温度升高而减小的物质是________.
(2)t1℃时,甲、乙两种物质的溶解度______.
(3)要使乙的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是_______.
(4)要使甲从其饱和溶液中析出,可用________的方法.
(5)t2℃时,甲的饱和溶液中溶质的质量分数是_________.
【答案】乙 相等 降温 降温 37.5%
【解析】
(1)由甲、乙两种固体物质的溶解度曲线可知,乙物质溶解度随温度升高而减小;
(2)由甲、乙两种固体物质的溶解度曲线可知,在t1℃时,甲、乙两种物质的溶解度曲线交与一点,甲、乙两种物质的溶解度相等;
(3)由于乙物质的溶解度随温度的升高而减小.所以,要使乙的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是降温;
(4)由于甲物质的溶解度随温度的升高而增大.所以,要使甲从其饱和溶液中析出,可用降温的方法;
(5)由甲的溶解度曲线可知,在t2℃时,甲的溶解度是60g,甲的饱和溶液中溶质的质量分数是![]()

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
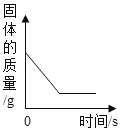
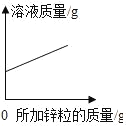
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D