题目内容
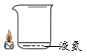
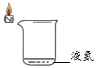
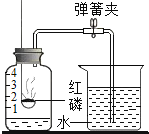
【题目】同学们发现有一种“氮气灭火装置”能利用液氮(沸点为-196℃)产生的大量氮气来灭火。他们用氮气进行如右图所示实验,却发现蜡烛未熄灭。
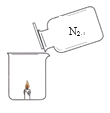
(查阅资料)氮气密度略小于空气;压强不变时,气体温度越低,密度越大。
(1)结合氮气性质分析,右图蜡烛未熄灭的原因可能是_______。
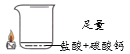
实验1:探究氮气能否用来灭火(所用容器均为隔热材料,下同)
实验编号 | 1-1 | 1-2 | 1-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛持续燃烧 | 蜡烛缓慢熄灭 | 蜡烛熄灭 |
(2)实验前有同学提出,由液氮汽化产生的氮气温度低,密度足够大,会向下流动隔 绝可燃物周围的氧气。依据实验1判断,这种假设_____(填“成立”或“不成立”)。
(3)有同学根据实验1提出新假设,氮气灭火可能与可燃物周围氮气的含量有关。可 能支持这一假设的实验现象是_______(填实验1中的实验编号)。
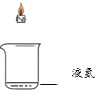
实验2:探究灭火与氮气含量是否有关
实验编号 | 2-1 | 2-2 | 2-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛没有熄灭 | 蜡烛缓慢熄灭 |
(4)实验2中,蜡烛所在位置氮气含量最高的是_________(填实验编号)。
(5)推测实验2-3的现象是________。
(6)反思实验2,除氮气含量外,影响蜡烛燃烧的其它可能因素是________。
(7)结合上述实验,下列关于 “氮气灭火装置”使用的说法中,合理的是______(填字母序号)。
A. 从高处向低处喷洒使用
B. 可燃物火焰熄灭后,还需持续通气一段时间
C. 在有少量排气口的封闭空间中使用时,效果好于开放空间
【答案】氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气 不成立 1-2 2-3 蜡烛熄灭(或蜡烛迅速熄灭,合理即可) 温度 BC
【解析】
(1)由题文知氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气,故填氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气;
(2)实验1-1和实验1-2对比,说明虽然液氮汽化产生的氮气温度低,但是密度没有大到能使烧杯下端蜡烛熄灭,仅使烧杯口端的蜡烛缓慢熄灭,在对比实验1-3中二氧化碳的灭火效果,可知这种假设不成立,故填不成立;
(3)实验1-2蜡烛熄灭而实验1-1蜡烛继续燃烧,如果氮气灭火可能与可燃物周围氮气的含量有关,说明实验1-2蜡烛周围氮气含量比实验1-1蜡烛周围氮气含量高,故填1-2;
(4)由实验2-1和2-2可知,越接近液氮,蜡烛越容易熄灭,说明越接近液氮,氮气浓度越高,可知蜡烛所在位置氮气含量最高的应该是实验2-3,故填2-3;
(5)由前分析可知越接近液氮处氮气浓度越高,蜡烛越容易熄灭,故填蜡烛熄灭(或蜡烛迅速熄灭,合理即可);
(6)液氮汽化需要吸热,越接近液氮,温度越低,温度低也可能影响蜡烛的燃烧,故填温度;
(7)
A、氮气的密度比空气小,从高处向低处喷洒使用,不能达到灭火的效果,故不符合题意;
B、可燃物火焰熄灭后,还需持续通气一段时间,避免热的可燃物和氧气接触重新燃烧,故符合题意;
C、在有少量排气口的封闭空间中使用氮气灭火时,能增加空间内氮气的浓度,灭火效果好于开放空间,故符合题意;故填BC。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】甲、乙、丙、丁、戊分别代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,它们之间相互反应的关系如图所示。已知物质与戊的反应中:戊与甲或戊与乙的反应类型不同于其它几个反应;丙与戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。下列对应关系正确的是( )
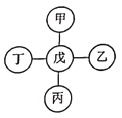
甲 | 乙 | 丙 | 丁 | 戊 | |
A | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 碳酸钙 | 稀盐酸 | 氢氧化钡 | 铁 |
C | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
D | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
A. AB. BC. CD. D
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为______________。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_____7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是________。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是________;步骤④的现象是________。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是________。
(6)丁同学认为丙同学的实验还不够严谨,还应考虑________对Cu与CuCl2溶液反应的影响。