题目内容
【题目】实验室有两瓶保管不当的试剂(如图1),左瓶残缺的标签中只剩下“Na”和“10%”字样,已知它是NaCl、NaOH、Na2CO3、NaHCO3中的一种;右瓶是敞口放置的30%的NaOH溶液。同学们很感兴趣,决定对其成分进行探究:

Ⅰ.甲同学对左瓶标签残缺的溶液展开研究:
(提出问题)这瓶试剂可能是什么溶液呢?
(交流讨论)根据受损标签的情况判断,这瓶试剂不可能是_____。(填字母)
A 酸 B 碱 C 盐
(查阅资料)
①Na2CO3和NaHCO3溶液都呈碱性。
②测定室温(20℃)时,四种物质的溶解度的数据如下
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度g | 36 | 109 | 215 | 9.6 |
(得出结论)根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是_____。
(设计实验并继续探究)
(1)用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是_____。
(2)为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加足量的 _____ | 有气泡产生 | 该溶液是_____ 相关的化学方程式_____ |
Ⅱ.乙同学对右瓶敞口放置的溶液展开研究:
(1)乙同学根据氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠,对其变质情况进行了如下探究。
(猜想与假设)该氢氧化钠溶液已部分变质。氢氧化钠溶液变质的反应方程式是_____。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
a.取少量该溶液于一支试管中,加入足量_____ | 有白色沉淀产生 | 该氢氧化钠溶液已变质 |
b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加_____ /td> | _____ | 该氢氧化钠溶液已部分变质 |
实验步骤a中加入的试剂必须足量的原因是:
(拓展探究)乙同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入适量的_____溶液,充分反应后,经_____操作,即可除去该氢氧化钠溶液中含有的杂质。
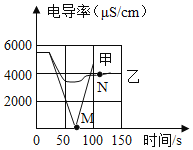
Ⅲ.丙同学查阅资料得知:碳酸钠与稀盐酸反应分两步进行:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,他取14.6g变质的氢氧化钠固体样品(不含水)于锥形瓶中,加入50.0g水,充分溶解,再向锥形瓶中滴加的溶质质量分数为7.3%的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的总质量关系如图2所示。下列说法正确的是_____。
A N点的溶液表示氢氧化钠被恰好完全反应
B PQ段(不含P点)溶液的pH<7
C NP段表示产生气体的过程,a的值为210.2
D 该固体样品中氢氧化钠的质量为8.0g。
【答案】A NaHCO3 NaCl 盐酸 Na2CO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2NaOH+CO2=Na2CO3+H2O CaCl2或BaCl2 无色酚酞(或CuSO4溶液) 酚酞变红(或产生蓝色沉淀) Ca(OH)2或Ba(OH)2 过滤 BC
【解析】
Ⅰ、{交流讨论}受损标签中含有钠元素,酸中不含有金属元素,故不可能是酸,故填A。
{得出结论}根据常温下碳酸氢钠的溶液为9.6g,可判断常温下碳酸氢钠的饱和溶液的溶质质量分数=![]() ×100%=8.8%,标签上的溶质质量分数是10%,不可能是碳酸氢钠,故填NaHCO3.
×100%=8.8%,标签上的溶质质量分数是10%,不可能是碳酸氢钠,故填NaHCO3.
{设计实验并继续探究}(1)溶液的pH大于7,说明溶液呈碱性,而氯化钠的溶液呈中性,不可能是氯化钠溶液,故填NaCl;
(2)加入某种试剂,会产生大量的气泡,说明是碳酸钠与酸的反应,故不会是氢氧化钠,应该是碳酸钠,加入的试剂是酸,可以是盐酸也可以是稀硫酸,故填:盐酸,Na2CO3;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,故反应的化学方程式写为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
Ⅱ、{猜想与假设}氢氧化钠能够和二氧化碳反应产生碳酸钠和水而变质,故反应的化学方程式写为:2NaOH+CO2=Na2CO3+H2O。
{实验与结论}根据实验结论:该氢氧化钠溶液已变质,说明其中含有碳酸钠,所以要检验是否含有碳酸根即可,又因为第二步中需要检验是否含有氢氧根,而碳酸钠也显碱性,所以第一步加入的试剂不仅要验证出有碳酸根离子,还需要除去碳酸根离子,所以加入试剂氯化钙或氯化钡溶液即可,因为氯化钙和氯化钡溶液均显中性,与碳酸钠反应生成碳酸钙或碳酸钡沉淀和氯化钠,氯化钠也显中性,所以加入氯化钙或氯化钡溶液,如果有白色沉淀生成,说明有碳酸钠存在,即已经变质,故填CaCl2或BaCl2;
将步骤a所得的液体静置,取上层清液于另一支试管中,滴加酚酞试液或硫酸铜溶液,如果变红或生成蓝色沉淀,说明溶液显碱性,即含有氢氧化钠,说明部分变质,故填无色酚酞(或CuSO4溶液);
观察到的现象是酚酞变红(或产生蓝色沉淀),故填酚酞变红(或产生蓝色沉淀)。
{拓展与应用}除去碳酸钠主要是除去其中的碳酸根离子,可以用钙离子或钡离子把碳酸根离子沉淀出来,又因为不能引入新的杂质,所以加入氢氧化钙或氢氧化钡即可,故填:Ca(OH)2或Ba(OH)2;
通过过滤将碳酸钙沉淀过滤出来,得到的滤液就是氢氧化钠溶液,故填过滤。
Ⅲ、氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,所以加入盐酸后,锥形瓶中物质的总质量增大幅度大,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以锥形瓶中物质的总质量增大幅度小,所以MN段是氢氧化钠和盐酸、碳酸钠和盐酸反应生成碳酸氢钠和氯化钠的过程,NP段是碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳的过程。
与碳酸氢钠反应的盐酸质量为50g,设生成二氧化碳质量为x
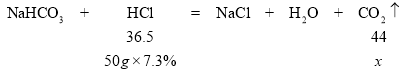
36.5:44=(50g×7.3%):x x=4.4g
设原固体中碳酸钠的质量为y
y×![]() ×100%=4.4g×
×100%=4.4g×![]() ×100% y=10.6g
×100% y=10.6g
A 通过推导可知,N点的溶液表示氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,选项错误;
B 通过推导可知,PQ段(不含P点)溶液的pH<7,选项正确;
C 反应后锥形瓶中物质的总质量是:a=150g+64.6g﹣4.4g=210.2g,选项正确;
D 氢氧化钠的质量是:14.6g﹣10.6g=4g,选项错误,故选BC。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作 | 实验现象 |
如图所示,将产生的气体________________ | _____________________ |
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物
【题目】NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:

(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______
(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的是_____________。(填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的最好方法是_______________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液)
实验序号 | 反应温度/℃ | 反应时间/min | 反应pH值 | Mg2+的沉淀率/% |
a | 40 | 60 | 10 | 90.1 |
b | 40 | 60 | 12 | 92.7 |
c | 40 | 90 | 12 | 93.6 |
d | 50 | 60 | 12 | 96.4 |
e | 50 | 90 | 12 | X |
①本实验研究了哪些因素对Mg2+的沉淀率的影响_______
②实验a和b对比,可得到的结论是_______
③表格中x的数值可能为__________(填字母)。
A 95.8 B 92.1 C 97.2 D 93.1