题目内容
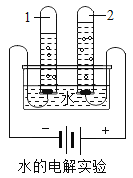
【题目】化学兴趣小组从一食品袋中获得一包脱氧剂,发现该脱氧剂为灰黑色粉末,若在空气中放置一段时间,有红棕色固体生成,研究后知:这是由于铁与空气中的_______和_______反应生成了铁锈。由此兴趣小组的同学对铁的性质产生了浓厚的兴趣,进行了一系列探究活动。
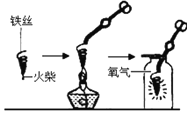
(探究一)铁丝燃烧程度与氧气浓度的关系。
(实验内容)取直径为![]() 铁丝,分别在体积分数
铁丝,分别在体积分数![]() 、
、![]() 、
、![]() 、
、![]() 的O2中实验。
的O2中实验。
实验现象:
|
|
|
|
|
实验现象 | 燃烧剧烈,效果好 | 燃烧比 | 燃烧比 | 难以燃烧, 只是发红 |
(结论)就直径为![]() 铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______
铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______![]() 填“剧烈”或“不剧烈”
填“剧烈”或“不剧烈”![]() 。
。
(探究二)铁丝燃烧产生火星四射现象的原因
(1)图中螺旋状铁丝的末端系一根火柴的作用是_______;
(3)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。如表记录了他将纯铁丝和不同含碳量的铁丝![]() 铁丝直径为
铁丝直径为![]() 放入氧气中燃烧时的实验现象。请你分析完成如表:
放入氧气中燃烧时的实验现象。请你分析完成如表:
物质 | 纯铁丝 | 含碳 | 含碳 | 含碳 |
燃烧时 的现象 | 无火星四射现象, 熔断 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | _______ |
通过以上实验,说明铁丝燃烧产生火星四射现象和_______![]() 填元素符号
填元素符号![]() 含量多少有关。
含量多少有关。
(探究三)铁粉与水蒸气反应后的产物
在常温下,铁与水几乎不反应。但在高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。乙同学设计了如图所示的实验进行探究。
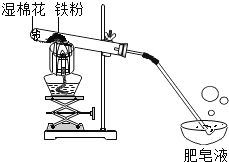
(1)试管尾部放一团湿棉花的目的是_______。
(2)探究生成的气体是什么?
待气体纯净后点燃,观察到管口有淡蓝色火焰,将干燥的冷烧杯倒罩在火焰上方,烧杯内壁出现水雾。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | Fe粉 | FeO |
|
|
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
能否溶于稀盐酸 | 能溶、冒气泡 | 能溶、无气泡 | 能容、无气泡 | 能溶、无气泡 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想1:剩余固体是![]() ;猜想2:剩余固体是_______。
;猜想2:剩余固体是_______。
(实验探究)丙同学取样品于试管中,滴加稀盐酸,发现固体全部溶解,有气泡冒出,丙同学认为猜想_______正确。
(实验证实)丁同学取样品![]() ,实验检验出其中含铁元素
,实验检验出其中含铁元素![]() ,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
(实验结论)铁和水蒸气反应的化学式表达式为_______
【答案】氧气 水 60% 剧烈 引燃铁丝 集气瓶底部没有预留少量水(或铺一层细沙) 剧烈燃烧,火星四射 C 提供水蒸气 H2O ![]() 和
和![]() 混合物 2 假如样品11.6g都是四氧化三铁,铁元素的质量是8.4g小于8.6g
混合物 2 假如样品11.6g都是四氧化三铁,铁元素的质量是8.4g小于8.6g ![]()
【解析】
铁生锈的实质是铁与空气中的氧气、水蒸气等发生了化学变化;
探究一:
根据表格可知,燃烧所需氧气的最低体积分数为60%;且氧气浓度越大,燃烧越剧烈;
探究二:
(1)铁丝着火点比较高,不易直接被点燃,铁丝末端系一根火柴在氧气中充分燃烧时产生大量热量,方便将铁丝引燃,即铁丝末端系一根火柴的作用是引燃铁丝;
(2)做铁丝燃烧实验时一般要在集气瓶底部预留少量水或铺一层细沙,以防止燃烧产生的高温熔化物把集气瓶炸裂;故本实验中集气瓶炸裂可能的原因就是:集气瓶底部没有预留少量水(或铺一层细沙);
(3)通过表中数据,可以看出铁丝含碳越高,燃烧火星越多;所以含碳0.6%的铁丝在氧气中剧烈燃烧,火星四射;也说明铁丝燃烧产生火星四射现象和C的含量多少有关;
探究三:
(1)根据题中信息,反应物是水蒸气和铁,因此湿棉花的作用是为反应提供水蒸气;
(2)纯净气体燃烧有淡蓝色火焰且生成水,说明该气体是氢气;
猜想与假设:
据题知黑色固体都能被磁铁吸引,故排除FeO和Fe2O3;又因反应生成一种氧化物,所以剩余固体也不可能单独是铁,那就只能是Fe3O4或者Fe和Fe3O4的混合物了,猜想1剩余固体是![]() ,故猜想2:剩余固体是Fe和Fe3O4混合物;
,故猜想2:剩余固体是Fe和Fe3O4混合物;
实验探究:
滴入盐酸,固体全部溶解且有气泡冒出,故不可能是猜想1,因Fe3O4和稀盐酸反应无气泡;Fe和Fe3O4都能溶于盐酸,且铁与盐酸反应生成氢气,符合条件,故猜想2正确;
实验证实:
假如样品11.6g都是四氧化三铁,铁元素的质量=![]() ,小于8.6g,所以是四氧化三铁和铁的混合物;
,小于8.6g,所以是四氧化三铁和铁的混合物;
实验结论:
故铁和水蒸气反应化学式表达式为:![]() 。
。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】古人云“处处留心皆学问”,你若善于观察,就会获取更多的新知识。
(发现问题)在一次探究活动中,小强用塑料吸管向新制的澄清石灰水中吹气,在吹气的过程中发现石灰水先出现浑浊,后又变澄清,他感到很意外。于是小强又将纯净的二氧化碳通入新制的澄清石灰水中,观察到的现象与上次相同。
(1)请写出石灰水变浑浊的方程式________;小强做第二个实验的目的是________________。
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2。由此,小强推测出Ca(HCO3)2的一条物理性质是能溶于水,写出CO2与CaCO3和H2O反应生成Ca(HCO3)2的化学方程式_________________________。
此外,小强还想了解Ca(HCO3)2的化学性质,提出了如下猜想:
(提出猜想)Ca(HCO3)2受热能否分解?
(查阅资料)Ca(HCO3)2受热分解生成CaCO3、H2O和CO2
(设计方案)小强用高锰酸钾制取氧气的发生装置来加热Ca(HCO3)2,加热时试管口要略_________倾斜,目的是__________________________________________。
(实验过程)小强在实验室找到一瓶Ca(HCO3)2粉末,取少量放入试管中进行加热,观察到试管口附近有小液滴产生。据此,小强得出结论:Ca(HCO3)2受热能够分解。
(反思评价)(1)小波认为小强的实验不能证明Ca(HCO3)2受热一定分解了,小波的理由是_______。
(2)请你设计实验方案,验证加热过程中有CO2产生。
选用试剂 | 实验操作方法 | 预想实验现象 | 结论 |
澄清石灰水 | 取适量Ca(HCO3)2粉末于试管中进行加热,将产生气体通入澄清石灰水中 | _________________ | 有CO2生成 |
(3)小红发现 CO2与CaCO3和H2O反应生成Ca(HCO3)2的化学反应方程式与Ca(HCO3)2受热分解的方程式在形式上近乎相反,于是联想到二氧化碳溶于水的过程也有类似情况,进行了如下课后小实验:
①将二氧化碳气体通入紫色石蕊溶液中,观察现象;
②将第①步实验得到的溶液置于酒精的火焰上加热,观察现象。
则下列选项中与小红进行的①②两步实验中石蕊溶液颜色变化情况相符是____(填字母)
A 紫色→红色→无色 B 红色→紫色→无色
C 红色→紫色→红色 D 紫色→红色→紫色
写出小红第①步实验中发生的反应的化学方程式_________________________,小红第②步实验中发生的化学反应属于__________反应(填反应类型)。
【题目】根据表中内容回答下列问题。
| 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(1)将接近饱和的澄清石灰水变为饱和,除增加溶质的方法以外,还可以通过___、____达到。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是____。
(3)向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”、“不变”或“减小”)。
(4)20℃时,氯化钠饱和溶液中溶质的质量分数为____(结果保留至0.1%)。
【题目】某兴趣小组对KClO3分解反应的催化剂进行探究,在相同的加热条件下,用如图装置完成表中实验:
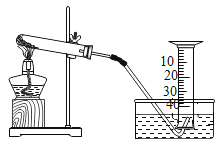
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50 mLO2所需时间/s |
实验1 | 5 | ﹣ | ﹣ | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是______________。
(2)表中所列3种催化剂的催化效果最佳的是______________(填物质名称),该物质为_____________色固体。写出KClO3在该物质催化下受热分解的符号表达式:__________________。
(3)KClO3中Cl元素的化合价为_______________,试写出KClO3中的阴离子_____________。
(4)由实验1和实验4可知,KCl__________(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50 mL O2,所需时间明显少于171 s,解释原因:______________。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50 mL O2所需时间外,还可以测量相同时间内_____________。
【题目】下图是实验室常用的制取气体的发生装置和收集装置。
(1)实验室用A装置制取氧气的化学方程式是______________,实验室用B装置制取氧气的化学方程式是________________。
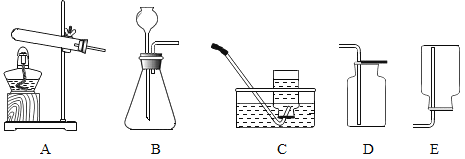
(2)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,有关化学方程式为:![]() ,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为___________(用字母序号填空),收集装置为___________(用字母序号填空)。
,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为___________(用字母序号填空),收集装置为___________(用字母序号填空)。
(3)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2。请你参与下列的探究并回答问题。
(提出问题)上述酸和碳酸盐的反应是否适合在实验室制取CO2?
(方案设计)大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是_________________。
讨论后大家设计了如下三个实验进行对比分析。
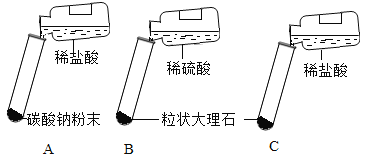
(实验与结论)
实验 | 实验现象 | 实验内容 |
A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,反应几乎停止。 | 无法持续产生CO2,不能用于实验室制取CO2 |
C | 产生气泡,速率适中 | 速率适中持续产生CO2,能用于实验室制取CO2 |
根据探究结论,实验室制取二氧化碳选择第C组药品,该药品制取二氧化碳的反应原理为___________________________ (用化学方程式表示)_______________;验满方法是______________; 检验方法二氧化碳的是__________________。
(拓展与迁移)
(4)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:________________________。
(5)如图:为了探究二氧化碳能否与水反应,现取用三朵紫色石蕊染成的干花(石蕊是一种色素,它遇酸变成红色)进行实验。
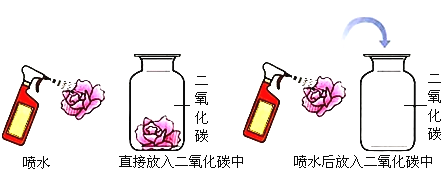
现象:第一朵紫色干花喷上水,紫花不变色 ;第二朵紫色干花直接放入盛满二氧化碳的集气瓶中,紫花也不变色;第三朵紫色干花先喷上水,再放入盛二氧化碳的集气瓶中,紫花_______(填写关于颜色的现象)。
结论:以上实验现象说明: ________________。反应的化学方程式是:___________________________________