题目内容
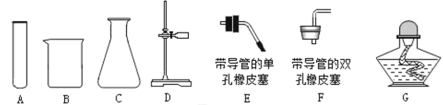
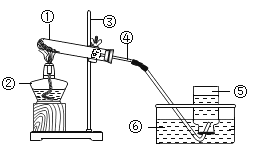
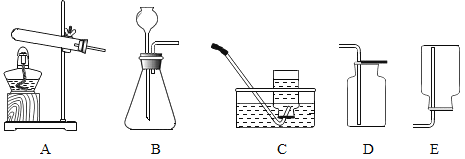
【题目】下图是实验室常用的制取气体的发生装置和收集装置。
(1)实验室用A装置制取氧气的化学方程式是______________,实验室用B装置制取氧气的化学方程式是________________。
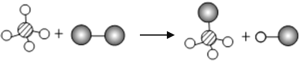
(2)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,有关化学方程式为:![]() ,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为___________(用字母序号填空),收集装置为___________(用字母序号填空)。
,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为___________(用字母序号填空),收集装置为___________(用字母序号填空)。
(3)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2。请你参与下列的探究并回答问题。
(提出问题)上述酸和碳酸盐的反应是否适合在实验室制取CO2?
(方案设计)大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是_________________。
讨论后大家设计了如下三个实验进行对比分析。
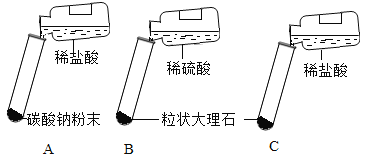
(实验与结论)
实验 | 实验现象 | 实验内容 |
A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,反应几乎停止。 | 无法持续产生CO2,不能用于实验室制取CO2 |
C | 产生气泡,速率适中 | 速率适中持续产生CO2,能用于实验室制取CO2 |
根据探究结论,实验室制取二氧化碳选择第C组药品,该药品制取二氧化碳的反应原理为___________________________ (用化学方程式表示)_______________;验满方法是______________; 检验方法二氧化碳的是__________________。
(拓展与迁移)
(4)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:________________________。
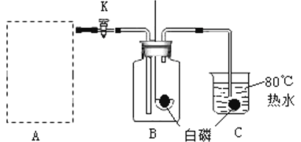
(5)如图:为了探究二氧化碳能否与水反应,现取用三朵紫色石蕊染成的干花(石蕊是一种色素,它遇酸变成红色)进行实验。
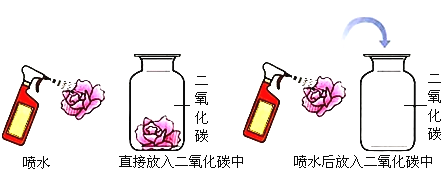
现象:第一朵紫色干花喷上水,紫花不变色 ;第二朵紫色干花直接放入盛满二氧化碳的集气瓶中,紫花也不变色;第三朵紫色干花先喷上水,再放入盛二氧化碳的集气瓶中,紫花_______(填写关于颜色的现象)。
结论:以上实验现象说明: ________________。反应的化学方程式是:___________________________________
【答案】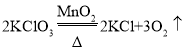
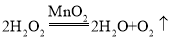 B D 浓盐酸具有强挥发性,会使二氧化碳中混有氯化氢杂质 稀盐酸和碳酸钙生成氯化钙、水和二氧化碳
B D 浓盐酸具有强挥发性,会使二氧化碳中混有氯化氢杂质 稀盐酸和碳酸钙生成氯化钙、水和二氧化碳 ![]() 用燃着的木条被在集气瓶口(不能伸入瓶内),如果火焰熄灭,证明收集已满 将生成的气体通入澄清的石灰水,石灰水变浑浊,证明该气体为二氧化碳 制取的气体要纯净 变红色 二氧化碳和水反应生成碳酸
用燃着的木条被在集气瓶口(不能伸入瓶内),如果火焰熄灭,证明收集已满 将生成的气体通入澄清的石灰水,石灰水变浑浊,证明该气体为二氧化碳 制取的气体要纯净 变红色 二氧化碳和水反应生成碳酸 ![]()
【解析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,过氧化氢在二氧化锰催化作用下生成水和氧气,稀盐酸和碳酸钙生成氯化钙、水和二氧化碳,二氧化碳和水反应生成碳酸。
(1)A装置试管口没有棉花,故实验室用A装置制取氧气的反应是氯酸钾和二氧化锰加热生成氯化钾和氧气,反应的化学方程式是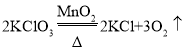 ,实验室用B装置制取氧气的反应是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式是
,实验室用B装置制取氧气的反应是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式是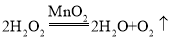 。
。
(2)块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,故实验室制取硫化氢的发生装置为B,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,故收集装置为D。
(3)[方案设计]浓盐酸不适合用于实验室制取CO2,原因是浓盐酸具有强挥发性,会使二氧化碳中混有氯化氢杂质。
实验室制取二氧化碳选择第C组药品,药品制取二氧化碳的反应原理为稀盐酸和碳酸钙生成氯化钙、水和二氧化碳,反应的方程式为![]() ;验满方法是用燃着的木条被在集气瓶口(不能伸入瓶内),如果火焰熄灭,证明收集已满;检验方法二氧化碳的是将生成的气体通入澄清的石灰水,石灰水变浑浊,证明该气体为二氧化碳。
;验满方法是用燃着的木条被在集气瓶口(不能伸入瓶内),如果火焰熄灭,证明收集已满;检验方法二氧化碳的是将生成的气体通入澄清的石灰水,石灰水变浑浊,证明该气体为二氧化碳。
(4)在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等,需要考虑的因素:制取的气体要纯净。
(5)二氧化碳不能使紫色石蕊干花变色,二氧化碳和水反应生成的碳酸能使紫色石蕊干花变红色。
现象:第一朵紫色干花喷上水,紫花不变色 ;第二朵紫色干花直接放入盛满二氧化碳的集气瓶中,紫花也不变色;第三朵紫色干花先喷上水,再放入盛二氧化碳的集气瓶中,紫花变红色。
结论:以上实验现象说明二氧化碳和水反应生成碳酸。反应的化学方程式是
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解快慢的因素。实验步骤及现象如下:
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的浓度 | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | t3 |
④ | 15 | 20 | 0.1 | t4 |
(1)对比①②两个实验,若t1>t2,则可得出的结论是:_____。
(2)能说明过氧化氢分解快慢与其浓度有关的实验是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?实验步骤及现象如下:
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入0.5g氧化铁粉末,并将带火星的木条分别伸入A、B两支试管中,观察现象。 | A试管中产生大量气泡,带火星的木条复燃;_____ |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把火星的木条伸入试管中,观察现象。 | 试管中产生大量气泡,带火星的木条复燃; |
Ⅲ.待实验Ⅱ中没有现象时,将试管中的反应剩余物过滤,并将滤渣洗涤、干燥、称量。 | 所得固体质量为_____g; |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入0.5g氧化铁粉末,向D试管中加入0.5g二氧化锰粉末,观察现象。 | —— |
(1)补充完成上述实验探究中表格的实验现象:①_____。②_____g。
(2)继续完成以下问题:
(实验结论)
①实验II、III证明_____。综上所述:氧化铁可以作过氧化氢分解的催化剂。
②写出氧化铁催化过氧化氢分解的符号表达式_____。
(实验评价)
③实验设计IV的目的是_____;
(实验拓展)
④查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A 二氧化锰只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质也可能是其他反应的反应物或生成物
【题目】化学兴趣小组从一食品袋中获得一包脱氧剂,发现该脱氧剂为灰黑色粉末,若在空气中放置一段时间,有红棕色固体生成,研究后知:这是由于铁与空气中的_______和_______反应生成了铁锈。由此兴趣小组的同学对铁的性质产生了浓厚的兴趣,进行了一系列探究活动。
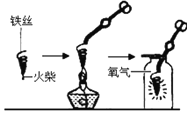
(探究一)铁丝燃烧程度与氧气浓度的关系。
(实验内容)取直径为![]() 铁丝,分别在体积分数
铁丝,分别在体积分数![]() 、
、![]() 、
、![]() 、
、![]() 的O2中实验。
的O2中实验。
实验现象:
|
|
|
|
|
实验现象 | 燃烧剧烈,效果好 | 燃烧比 | 燃烧比 | 难以燃烧, 只是发红 |
(结论)就直径为![]() 铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______
铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______![]() 填“剧烈”或“不剧烈”
填“剧烈”或“不剧烈”![]() 。
。
(探究二)铁丝燃烧产生火星四射现象的原因
(1)图中螺旋状铁丝的末端系一根火柴的作用是_______;
(3)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。如表记录了他将纯铁丝和不同含碳量的铁丝![]() 铁丝直径为
铁丝直径为![]() 放入氧气中燃烧时的实验现象。请你分析完成如表:
放入氧气中燃烧时的实验现象。请你分析完成如表:
物质 | 纯铁丝 | 含碳 | 含碳 | 含碳 |
燃烧时 的现象 | 无火星四射现象, 熔断 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | _______ |
通过以上实验,说明铁丝燃烧产生火星四射现象和_______![]() 填元素符号
填元素符号![]() 含量多少有关。
含量多少有关。
(探究三)铁粉与水蒸气反应后的产物
在常温下,铁与水几乎不反应。但在高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。乙同学设计了如图所示的实验进行探究。
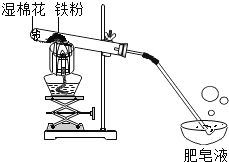
(1)试管尾部放一团湿棉花的目的是_______。
(2)探究生成的气体是什么?
待气体纯净后点燃,观察到管口有淡蓝色火焰,将干燥的冷烧杯倒罩在火焰上方,烧杯内壁出现水雾。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | Fe粉 | FeO |
|
|
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
能否溶于稀盐酸 | 能溶、冒气泡 | 能溶、无气泡 | 能容、无气泡 | 能溶、无气泡 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想1:剩余固体是![]() ;猜想2:剩余固体是_______。
;猜想2:剩余固体是_______。
(实验探究)丙同学取样品于试管中,滴加稀盐酸,发现固体全部溶解,有气泡冒出,丙同学认为猜想_______正确。
(实验证实)丁同学取样品![]() ,实验检验出其中含铁元素
,实验检验出其中含铁元素![]() ,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
(实验结论)铁和水蒸气反应的化学式表达式为_______