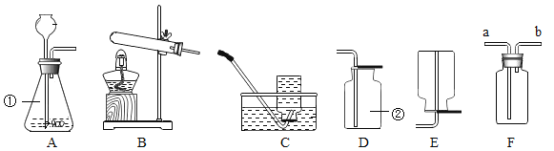
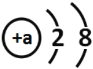题目内容
【题目】古人云“处处留心皆学问”,你若善于观察,就会获取更多的新知识。
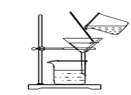
(发现问题)在一次探究活动中,小强用塑料吸管向新制的澄清石灰水中吹气,在吹气的过程中发现石灰水先出现浑浊,后又变澄清,他感到很意外。于是小强又将纯净的二氧化碳通入新制的澄清石灰水中,观察到的现象与上次相同。
(1)请写出石灰水变浑浊的方程式________;小强做第二个实验的目的是________________。
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2。由此,小强推测出Ca(HCO3)2的一条物理性质是能溶于水,写出CO2与CaCO3和H2O反应生成Ca(HCO3)2的化学方程式_________________________。
此外,小强还想了解Ca(HCO3)2的化学性质,提出了如下猜想:
(提出猜想)Ca(HCO3)2受热能否分解?
(查阅资料)Ca(HCO3)2受热分解生成CaCO3、H2O和CO2
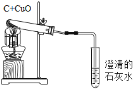
(设计方案)小强用高锰酸钾制取氧气的发生装置来加热Ca(HCO3)2,加热时试管口要略_________倾斜,目的是__________________________________________。
(实验过程)小强在实验室找到一瓶Ca(HCO3)2粉末,取少量放入试管中进行加热,观察到试管口附近有小液滴产生。据此,小强得出结论:Ca(HCO3)2受热能够分解。
(反思评价)(1)小波认为小强的实验不能证明Ca(HCO3)2受热一定分解了,小波的理由是_______。
(2)请你设计实验方案,验证加热过程中有CO2产生。
选用试剂 | 实验操作方法 | 预想实验现象 | 结论 |
澄清石灰水 | 取适量Ca(HCO3)2粉末于试管中进行加热,将产生气体通入澄清石灰水中 | _________________ | 有CO2生成 |
(3)小红发现 CO2与CaCO3和H2O反应生成Ca(HCO3)2的化学反应方程式与Ca(HCO3)2受热分解的方程式在形式上近乎相反,于是联想到二氧化碳溶于水的过程也有类似情况,进行了如下课后小实验:
①将二氧化碳气体通入紫色石蕊溶液中,观察现象;
②将第①步实验得到的溶液置于酒精的火焰上加热,观察现象。
则下列选项中与小红进行的①②两步实验中石蕊溶液颜色变化情况相符是____(填字母)
A 紫色→红色→无色 B 红色→紫色→无色
C 红色→紫色→红色 D 紫色→红色→紫色
写出小红第①步实验中发生的反应的化学方程式_________________________,小红第②步实验中发生的化学反应属于__________反应(填反应类型)。
【答案】![]() 排除人呼出气体中其他成分干扰
排除人呼出气体中其他成分干扰 ![]() 向下 防止冷凝水倒流入试管使试管炸裂 药品Ca(HCO3)2中可能含有水分 澄清石灰水变浑浊 D
向下 防止冷凝水倒流入试管使试管炸裂 药品Ca(HCO3)2中可能含有水分 澄清石灰水变浑浊 D ![]() 分解
分解
【解析】
(1)二氧化碳与石灰水变浑浊的反应原理:CO2+Ca(OH)2=CaCO3↓+H2O;小强做第二个实验的目的是:排除人呼出气体中其他成分干扰;
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2。由此,小强推测出Ca(HCO3)2的一条物理性质是能溶于水,写出CO2与CaCO3和H2O反应生成Ca(HCO3)2的化学方程式:CaCO3+H2O+CO2=Ca(HCO3)2;
设计方案:小强用高锰酸钾制取氧气的发生装置来加热Ca(HCO3)2,加热时试管口要略向下倾斜,目的是:水蒸气冷凝回流造成试管炸裂;
反思评价:(1)小波认为小强的实验不能证明Ca(HCO3)2受热一定分解了,小波的理由是:药品Ca(HCO3)2中可能含有水分;
(2)取适量Ca(HCO3)2粉末于试管中进行加热,将产生气体通入澄清石灰水中,石灰水变浑浊,则有二氧化碳产生;
(3)①将二氧化碳气体通入紫色石蕊溶液中形成碳酸,碳酸使紫色石蕊溶液变红,
②将第①步实验得到的碳酸溶液置于酒精的火焰上加热,碳酸分解产生二氧化碳和水,石蕊溶液由红色变为紫色,故选:D。
小红第①步实验中发生的反应的化学方程式:CO2+H2O=H2CO3,小红第②步实验中的反应
是碳酸受热分解:H2CO3=H2O+CO2↑,符合“一变多”,属于分解反应。

【题目】某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解快慢的因素。实验步骤及现象如下:
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的浓度 | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | t3 |
④ | 15 | 20 | 0.1 | t4 |
(1)对比①②两个实验,若t1>t2,则可得出的结论是:_____。
(2)能说明过氧化氢分解快慢与其浓度有关的实验是_____(填实验序号)。
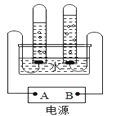
(探究二)探究氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?实验步骤及现象如下:
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入0.5g氧化铁粉末,并将带火星的木条分别伸入A、B两支试管中,观察现象。 | A试管中产生大量气泡,带火星的木条复燃;_____ |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把火星的木条伸入试管中,观察现象。 | 试管中产生大量气泡,带火星的木条复燃; |
Ⅲ.待实验Ⅱ中没有现象时,将试管中的反应剩余物过滤,并将滤渣洗涤、干燥、称量。 | 所得固体质量为_____g; |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入0.5g氧化铁粉末,向D试管中加入0.5g二氧化锰粉末,观察现象。 | —— |
(1)补充完成上述实验探究中表格的实验现象:①_____。②_____g。
(2)继续完成以下问题:
(实验结论)
①实验II、III证明_____。综上所述:氧化铁可以作过氧化氢分解的催化剂。
②写出氧化铁催化过氧化氢分解的符号表达式_____。
(实验评价)
③实验设计IV的目的是_____;
(实验拓展)
④查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A 二氧化锰只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质也可能是其他反应的反应物或生成物
【题目】化学兴趣小组从一食品袋中获得一包脱氧剂,发现该脱氧剂为灰黑色粉末,若在空气中放置一段时间,有红棕色固体生成,研究后知:这是由于铁与空气中的_______和_______反应生成了铁锈。由此兴趣小组的同学对铁的性质产生了浓厚的兴趣,进行了一系列探究活动。
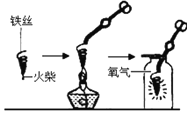
(探究一)铁丝燃烧程度与氧气浓度的关系。
(实验内容)取直径为![]() 铁丝,分别在体积分数
铁丝,分别在体积分数![]() 、
、![]() 、
、![]() 、
、![]() 的O2中实验。
的O2中实验。
实验现象:
|
|
|
|
|
实验现象 | 燃烧剧烈,效果好 | 燃烧比 | 燃烧比 | 难以燃烧, 只是发红 |
(结论)就直径为![]() 铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______
铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______![]() 填“剧烈”或“不剧烈”
填“剧烈”或“不剧烈”![]() 。
。
(探究二)铁丝燃烧产生火星四射现象的原因
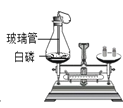
(1)图中螺旋状铁丝的末端系一根火柴的作用是_______;
(3)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。如表记录了他将纯铁丝和不同含碳量的铁丝![]() 铁丝直径为
铁丝直径为![]() 放入氧气中燃烧时的实验现象。请你分析完成如表:
放入氧气中燃烧时的实验现象。请你分析完成如表:
物质 | 纯铁丝 | 含碳 | 含碳 | 含碳 |
燃烧时 的现象 | 无火星四射现象, 熔断 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | _______ |
通过以上实验,说明铁丝燃烧产生火星四射现象和_______![]() 填元素符号
填元素符号![]() 含量多少有关。
含量多少有关。
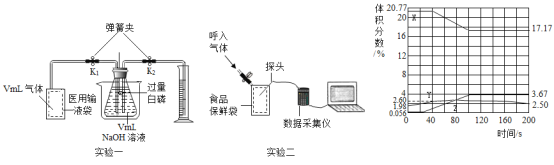
(探究三)铁粉与水蒸气反应后的产物
在常温下,铁与水几乎不反应。但在高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。乙同学设计了如图所示的实验进行探究。
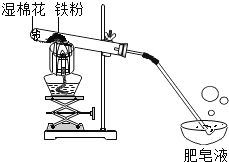
(1)试管尾部放一团湿棉花的目的是_______。
(2)探究生成的气体是什么?
待气体纯净后点燃,观察到管口有淡蓝色火焰,将干燥的冷烧杯倒罩在火焰上方,烧杯内壁出现水雾。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | Fe粉 | FeO |
|
|
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
能否溶于稀盐酸 | 能溶、冒气泡 | 能溶、无气泡 | 能容、无气泡 | 能溶、无气泡 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想1:剩余固体是![]() ;猜想2:剩余固体是_______。
;猜想2:剩余固体是_______。
(实验探究)丙同学取样品于试管中,滴加稀盐酸,发现固体全部溶解,有气泡冒出,丙同学认为猜想_______正确。
(实验证实)丁同学取样品![]() ,实验检验出其中含铁元素
,实验检验出其中含铁元素![]() ,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
(实验结论)铁和水蒸气反应的化学式表达式为_______