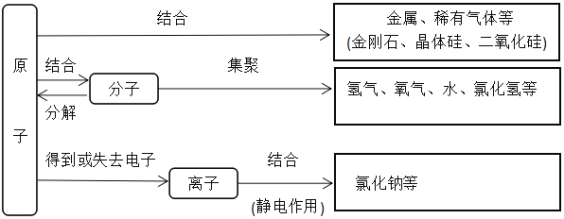
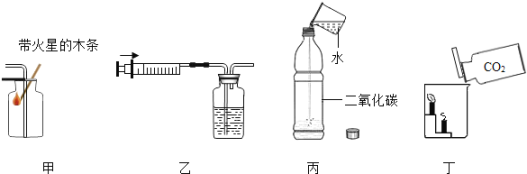
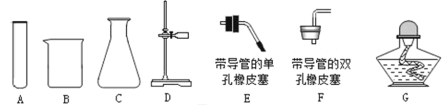
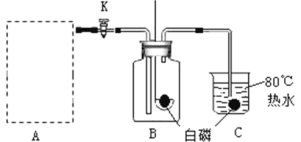
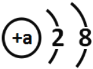ЬтФПФкШн
ЁОЬтФПЁПФГаЫШЄаЁзщЖдKClO3ЗжНтЗДгІЕФДпЛЏМСНјааЬНОПЃЌдкЯрЭЌЕФМгШШЬѕМўЯТЃЌгУШчЭМзАжУЭъГЩБэжаЪЕбщЃК

БрКХ | KClO3жЪСП/g | ДпЛЏМС | ДпЛЏМСжЪСП/g | ЪеМЏ50 mLO2ЫљашЪБМф/s |
ЪЕбщ1 | 5 | Љ | Љ | 171 |
ЪЕбщ2 | 5 | MnO2 | 0.5 | 49 |
ЪЕбщ3 | 5 | Fe2O3 | 0.5 | 58 |
ЪЕбщ4 | 5 | KCl | 0.5 | 154 |
ЃЈ1ЃЉЩшжУЪЕбщ1ЕФФПЕФЪЧ______________ЁЃ
ЃЈ2ЃЉБэжаЫљСа3жжДпЛЏМСЕФДпЛЏаЇЙћзюМбЕФЪЧ______________ЃЈЬюЮяжЪУћГЦЃЉЃЌИУЮяжЪЮЊ_____________ЩЋЙЬЬхЁЃаДГіKClO3дкИУЮяжЪДпЛЏЯТЪмШШЗжНтЕФЗћКХБэДяЪНЃК__________________ЁЃ
ЃЈ3ЃЉKClO3жаClдЊЫиЕФЛЏКЯМлЮЊ_______________ЃЌЪдаДГіKClO3жаЕФвѕРызг_____________ЁЃ
ЃЈ4ЃЉгЩЪЕбщ1КЭЪЕбщ4ПЩжЊЃЌKCl__________ЃЈЬюЁАгаЁБЛђЁАЮоЁБЃЉДпЛЏзїгУЁЃЮЌГжМгШШЬѕМўВЛБфЃЌгУЪЕбщ1дйМЬајЪеМЏ50 mL O2ЃЌЫљашЪБМфУїЯдЩйгк171 sЃЌНтЪЭдвђЃК______________ЁЃ
ЃЈ5ЃЉвЊБШНЯKClO3ЗжНтЗДгІжаВЛЭЌДпЛЏМСЕФДпЛЏаЇЙћЃЌГ§СЫВтСПЪеМЏ50 mL O2ЫљашЪБМфЭтЃЌЛЙПЩвдВтСПЯрЭЌЪБМфФк_____________ЁЃ
ЁОД№АИЁПзіЖдБШЃЈЖдееЃЉ ЖўбѕЛЏУЬ Кк 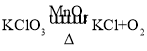 +5 ClO3- га ЩњГЩЮяжагаKClЃЌДпЛЏЗДгІ ЩњГЩбѕЦјЕФЬхЛ§
+5 ClO3- га ЩњГЩЮяжагаKClЃЌДпЛЏЗДгІ ЩњГЩбѕЦјЕФЬхЛ§
ЁОНтЮіЁП
ЃЈ1ЃЉЭЈЙ§ЖдБШВХФмжЊЕРЪЕбщ2ЁЂ3ЁЂ4жаМгШывЉЦЗКѓгаЮоДпЛЏзїгУЃЛ
ЃЈ2ЃЉГ§СЫМгШывЉЦЗВЛЭЌЭтЃЌЦфЫћЬѕМўЖМЯрЭЌЃЌИљОнЖдБШПЩжЊЃЌЪеМЏЯрЭЌЬхЛ§ЕФбѕЦјЃЌЪЕбщ2ЫљгУЪБМфзюЖЬЃЌМДЖўбѕЛЏУЬЕФДпЛЏаЇЙћзюКУЃЛИУЮяжЪЮЊКкЩЋЙЬЬхЃЛТШЫсМидкЖўбѕЛЏУЬЕФДпЛЏзїгУЯТМгШШЩњГЩТШЛЏМиКЭбѕЦјЃЌЗДгІЕФЗћКХБэДяЪНЮЊЃК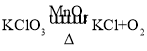 ЃЛ
ЃЛ
ЃЈ3ЃЉKClO3жаМиЮЊ+1МлЃЌбѕЮЊ-2МлЃЌгЩЛЏКЯМлДњЪ§КЭЮЊ0ЕФддђЃЌЙЪТШЮЊ+5МлЃЛKClO3ЪЧгЩK+КЭClO3-ЙЙГЩЕФЃЛ
ЃЈ4ЃЉгЩЪЕбщ1КЭЪЕбщ4ПЩжЊЃЌKClгаДпЛЏзїгУЃЛЮЌГжМгШШЬѕМўВЛБфЃЌгУЪЕбщ1дйМЬајЪеМЏЪеМЏ50mLO2ЃЌЫљашЪБМфУїЯдЩйгк171sЃЌЪЧвђЮЊТШЫсМиЗжНтЩњГЩЕФТШЛЏМиЖдЗДгІЦ№СЫДпЛЏзїгУЃЛ
ЃЈ5ЃЉвЊБШНЯKClO3ЗжНтЗДгІжаВЛЭЌДпЛЏМСЕФДпЛЏаЇЙћЃЌГ§СЫВтСПЪеМЏ50mLO2ЫљашЪБМфЭтЃЌЛЙПЩвдВтСПЯрЭЌЪБМфФкЪеМЏбѕЦјЕФЬхЛ§ЁЃ

 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИЁОЬтФПЁПФГЪЕбщаЁзщЖдЙ§бѕЛЏЧтЗжНтЗДгІНјааЬНОПЃК
ЃЈЬНОПвЛЃЉЬНОПгАЯьЙ§бѕЛЏЧтЗжНтПьТ§ЕФвђЫиЁЃЪЕбщВНжшМАЯжЯѓШчЯТЃК
ЗжБ№ШЁ5mLH2O2ШмвКНјааЪЕбщЃЌВтЖЈВњЩњ4mLO2ЫљашЪБМфЃЌЪЕбщНсЙћМЧТМШчЯТЃК
ЪЕбщађКХ | H2O2ШмвКЕФХЈЖШ | ЮТЖШЁц | MnO2ЗлФЉгУСП/g | ЗДгІЪБМф |
Ђй | 30 | 35 | 0 | t1 |
Ђк | 30 | 55 | 0 | t2 |
Ђл | 5 | 20 | 0.1 | t3 |
Ђм | 15 | 20 | 0.1 | t4 |
ЃЈ1ЃЉЖдБШЂйЂкСНИіЪЕбщЃЌШєt1>t2ЃЌдђПЩЕУГіЕФНсТлЪЧ:_____ЁЃ
ЃЈ2ЃЉФмЫЕУїЙ§бѕЛЏЧтЗжНтПьТ§гыЦфХЈЖШгаЙиЕФЪЕбщЪЧ_____ЃЈЬюЪЕбщађКХЃЉЁЃ
ЃЈЬНОПЖўЃЉЬНОПбѕЛЏЬњЃЈFe2O3ЃЉФмЗёзїЙ§бѕЛЏЧтШмвКЗжНтЕФДпЛЏМС?ШчЙћФмЃЌЦфДпЛЏаЇЙћШчКЮ?ЪЕбщВНжшМАЯжЯѓШчЯТЃК
ЪЕбщВНжш | ЪЕбщЯжЯѓ |
Ђё.ЗжБ№СПШЁ5mL5%Й§бѕЛЏЧтШмвКЗХШыAЁЂBСНжЇЪдЙмжаЃЌЯђAЪдЙмжаМгШы0.5gбѕЛЏЬњЗлФЉЃЌВЂНЋДјЛ№аЧЕФФОЬѕЗжБ№ЩьШыAЁЂBСНжЇЪдЙмжаЃЌЙлВьЯжЯѓЁЃ | AЪдЙмжаВњЩњДѓСПЦјХнЃЌДјЛ№аЧЕФФОЬѕИДШМЃЛ_____ |
Ђђ.Д§AЪдЙмжаУЛгаЯжЯѓЗЂЩњЪБЃЌжиаТМгШыЙ§бѕЛЏЧтШмвКЃЌВЂАбЛ№аЧЕФФОЬѕЩьШыЪдЙмжаЃЌЙлВьЯжЯѓЁЃ | ЪдЙмжаВњЩњДѓСПЦјХнЃЌДјЛ№аЧЕФФОЬѕИДШМЃЛ |
Ђѓ.Д§ЪЕбщЂђжаУЛгаЯжЯѓЪБЃЌНЋЪдЙмжаЕФЗДгІЪЃгрЮяЙ§ТЫЃЌВЂНЋТЫдќЯДЕгЁЂИЩдяЁЂГЦСПЁЃ | ЫљЕУЙЬЬхжЪСПЮЊ_____gЃЛ |
Ђє.ЗжБ№СПШЁ5mL5%Й§бѕЛЏЧтШмвКЗХШыCЁЂDСНжЇЪдЙмжаЃЌЯђCЪдЙмжаМгШы0.5gбѕЛЏЬњЗлФЉЃЌЯђDЪдЙмжаМгШы0.5gЖўбѕЛЏУЬЗлФЉЃЌЙлВьЯжЯѓЁЃ | ЁЊЁЊ |
ЃЈ1ЃЉВЙГфЭъГЩЩЯЪіЪЕбщЬНОПжаБэИёЕФЪЕбщЯжЯѓЃКЂй_____ЁЃЂк_____gЁЃ
ЃЈ2ЃЉМЬајЭъГЩвдЯТЮЪЬтЃК
ЃЈЪЕбщНсТлЃЉ
ЂйЪЕбщIIЁЂIIIжЄУї_____ЁЃзлЩЯЫљЪіЃКбѕЛЏЬњПЩвдзїЙ§бѕЛЏЧтЗжНтЕФДпЛЏМСЁЃ
ЂкаДГібѕЛЏЬњДпЛЏЙ§бѕЛЏЧтЗжНтЕФЗћКХБэДяЪН_____ЁЃ
ЃЈЪЕбщЦРМлЃЉ
ЂлЪЕбщЩшМЦIVЕФФПЕФЪЧ_____ЃЛ
ЃЈЪЕбщЭиеЙЃЉ
ЂмВщдФзЪСЯЕУжЊЃЌбѕЛЏЭЁЂСђЫсЭЁЂжэИЮЁЂТэСхЪэЕШвВПЩвдзіЙ§бѕЛЏЧтШмвКЗжНтЕФДпЛЏМСЁЃЯТСагаЙиДпЛЏМСЕФЫЕЗЈжае§ШЗЕФЪЧ_____ЁЃ
A ЖўбѕЛЏУЬжЛФмзїЙ§бѕЛЏЧтШмвКЗжНтЕФДпЛЏМС
B ЭЌвЛИіЛЏбЇЗДгІПЩвдгаЖржжДпЛЏМС
C ДпЛЏМСжЛФмМгПьЛЏбЇЗДгІЕФЫйТЪ
D гУзїДпЛЏМСЕФЮяжЪвВПЩФмЪЧЦфЫћЗДгІЕФЗДгІЮяЛђЩњГЩЮя
ЁОЬтФПЁПЮЊВтЖЈФГЛЦЭ(CuЉZnКЯН№)бљЦЗжааПЕФжЪСПЗжЪ§ЃЌФГбЇЯАаЁзщНјааСЫШчЯТЪЕбщЃКШЁ20gЛЦЭбљЦЗЃЌНЋЦфЗХдкЩеБжаЃЌШЛКѓАб80gЯЁСђЫсЗжЫФДЮМгШыЩеБжаЃЌЦфЗДгІЕФЧщПіШчЯТБэЫљЪОЃК
ВНжш | ЕквЛДЮ | ЕкЖўДЮ | ЕкШ§ДЮ | ЕкЫФДЮ |
МгШыЯЁСђЫсЕФжЪСП/g | 20 | 20 | 20 | 20 |
ЪЃгрЛЦЭбљЦЗЕФжЪСП/g | 17.4 | 14.8 | m | 13.2 |
(1)БэжаЕФmЕФжЕЮЊ___ЁЃ
(2)ДЫЛЦЭбљЦЗжааПЕФжЪСПЗжЪ§ЮЊ___ЁЃ
(3)ЫљгУЯЁСђЫсШмжЪЕФжЪСПЗжЪ§ЪЧ____(аДГіМЦЫуЙ§ГЬ)ЁЃ
ЁОЬтФПЁПЛЏбЇаЫШЄаЁзщДгвЛЪГЦЗДќжаЛёЕУвЛАќЭббѕМС,ЗЂЯжИУЭббѕМСЮЊЛвКкЩЋЗлФЉ,ШєдкПеЦјжаЗХжУвЛЖЮЪБМф,гаКьзиЩЋЙЬЬхЩњГЩ,баОПКѓжЊЃКетЪЧгЩгкЬњгыПеЦјжаЕФ_______КЭ_______ЗДгІЩњГЩСЫЬњатЁЃгЩДЫаЫШЄаЁзщЕФЭЌбЇЖдЬњЕФаджЪВњЩњСЫХЈКёЕФаЫШЄ,НјааСЫвЛЯЕСаЬНОПЛюЖЏЁЃ

ЃЈЬНОПвЛЃЉЬњЫПШМЩеГЬЖШгыбѕЦјХЈЖШЕФЙиЯЕЁЃ
ЃЈЪЕбщФкШнЃЉШЁжБОЖЮЊ![]() ЬњЫП,ЗжБ№дкЬхЛ§ЗжЪ§
ЬњЫП,ЗжБ№дкЬхЛ§ЗжЪ§![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕФO2жаЪЕбщЁЃ
ЕФO2жаЪЕбщЁЃ
ЪЕбщЯжЯѓЃК
|
|
|
|
|
ЪЕбщЯжЯѓ | ШМЩеОчСв,аЇЙћКУ | ШМЩеБШ | ШМЩеБШ | ФбвдШМЩе, жЛЪЧЗЂКь |
ЃЈНсТлЃЉОЭжБОЖЮЊ![]() ЬњЫПЖјбд,ШМЩеЫљашбѕЦјЕФзюЕЭЬхЛ§ЗжЪ§ЮЊ_______,ЧвбѕЦјХЈЖШдНДѓ,ШМЩеЯжЯѓдН_______
ЬњЫПЖјбд,ШМЩеЫљашбѕЦјЕФзюЕЭЬхЛ§ЗжЪ§ЮЊ_______,ЧвбѕЦјХЈЖШдНДѓ,ШМЩеЯжЯѓдН_______![]() ЬюЁАОчСвЁБЛђЁАВЛОчСвЁБ
ЬюЁАОчСвЁБЛђЁАВЛОчСвЁБ![]() ЁЃ
ЁЃ
ЃЈЬНОПЖўЃЉЬњЫПШМЩеВњЩњЛ№аЧЫФЩфЯжЯѓЕФдвђ
ЃЈ1ЃЉЭМжаТна§зДЬњЫПЕФФЉЖЫЯЕвЛИљЛ№ВёЕФзїгУЪЧ_______ЃЛ
ЃЈ3ЃЉаЁУїЖдЬњЫПдкбѕЦјжаШМЩеЮЊЪВУДЛсЛ№аЧЫФЩфНјааЬНОПЁЃШчБэМЧТМСЫЫћНЋДПЬњЫПКЭВЛЭЌКЌЬМСПЕФЬњЫП![]() ЬњЫПжБОЖЮЊ
ЬњЫПжБОЖЮЊ![]() ЗХШыбѕЦјжаШМЩеЪБЕФЪЕбщЯжЯѓЁЃЧыФуЗжЮіЭъГЩШчБэЃК
ЗХШыбѕЦјжаШМЩеЪБЕФЪЕбщЯжЯѓЁЃЧыФуЗжЮіЭъГЩШчБэЃК
ЮяжЪ | ДПЬњЫП | КЌЬМ | КЌЬМ | КЌЬМ |
ШМЩеЪБ ЕФЯжЯѓ | ЮоЛ№аЧЫФЩфЯжЯѓ, ШлЖЯ | ОчСвШМЩе МЋЩйЛ№аЧ | ОчСвШМЩе ЩйСПЛ№аЧ | _______ |
ЭЈЙ§вдЩЯЪЕбщ,ЫЕУїЬњЫПШМЩеВњЩњЛ№аЧЫФЩфЯжЯѓКЭ_______![]() ЬюдЊЫиЗћКХ
ЬюдЊЫиЗћКХ![]() КЌСПЖрЩйгаЙиЁЃ
КЌСПЖрЩйгаЙиЁЃ
ЃЈЬНОПШ§ЃЉЬњЗлгыЫЎеєЦјЗДгІКѓЕФВњЮя
дкГЃЮТЯТ,ЬњгыЫЎМИКѕВЛЗДгІЁЃЕЋдкИпЮТЯТ,ЬњгыЫЎеєЦјФмЗДгІЩњГЩвЛжжГЃМћЬњЕФбѕЛЏЮяКЭвЛжжЦјЬхЁЃввЭЌбЇЩшМЦСЫШчЭМЫљЪОЕФЪЕбщНјааЬНОПЁЃ
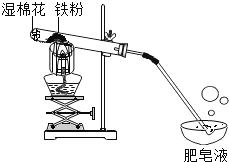
ЃЈ1ЃЉЪдЙмЮВВПЗХвЛЭХЪЊУоЛЈЕФФПЕФЪЧ_______ЁЃ
ЃЈ2ЃЉЬНОПЩњГЩЕФЦјЬхЪЧЪВУДЃП
Д§ЦјЬхДПОЛКѓЕуШМ,ЙлВьЕНЙмПкгаЕРЖЩЋЛ№бц,НЋИЩдяЕФРфЩеБЕЙеждкЛ№бцЩЯЗН,ЩеБФкБкГіЯжЫЎЮэЁЃЫЕУїЩњГЩЕФЦјЬхЪЧ_______ЁЃ
ЃЈ3ЃЉЬНОПЪдЙмжаЪЃгрЙЬЬхГЩЗжЪЧЪВУДЃП
ЃЈВщдФзЪСЯЃЉ
ГЃМћЬњЕФбѕЛЏЮя | FeЗл | FeO |
|
|
беЩЋЁЂзДЬЌ | КкЩЋЗлФЉ | КкЩЋЗлФЉ | КьзиЩЋЗлФЉ | КкЩЋОЇЬх |
ФмЗёБЛДХЬњЮќв§ | Фм | Зё | Зё | Фм |
ФмЗёШмгкЯЁбЮЫс | ФмШмЁЂУАЦјХн | ФмШмЁЂЮоЦјХн | ФмШнЁЂЮоЦјХн | ФмШмЁЂЮоЦјХн |
ЃЈГѕВНбщжЄЃЉЪдЙмжаЪЃгрЙЬЬхЮЊКкЩЋ,ФмШЋВПБЛДХЬњЮќв§ЁЃ
ЃЈВТЯыгыМйЩшЃЉВТЯы1ЃКЪЃгрЙЬЬхЪЧ![]() ЃЛВТЯы2ЃКЪЃгрЙЬЬхЪЧ_______ЁЃ
ЃЛВТЯы2ЃКЪЃгрЙЬЬхЪЧ_______ЁЃ
ЃЈЪЕбщЬНОПЃЉБћЭЌбЇШЁбљЦЗгкЪдЙмжа,ЕЮМгЯЁбЮЫс,ЗЂЯжЙЬЬхШЋВПШмНт,гаЦјХнУАГі,БћЭЌбЇШЯЮЊВТЯы_______е§ШЗЁЃ
ЃЈЪЕбщжЄЪЕЃЉЖЁЭЌбЇШЁбљЦЗ![]() ,ЪЕбщМьбщГіЦфжаКЌЬњдЊЫи
,ЪЕбщМьбщГіЦфжаКЌЬњдЊЫи![]() ,НјвЛВНжЄЪЕСЫЩЯЪіЪЃгрЙЬЬхЕФГЩЗжгыБћЭЌбЇЕФВТЯывЛжТЁЃРэгЩЪЧ_______ЁЃ
,НјвЛВНжЄЪЕСЫЩЯЪіЪЃгрЙЬЬхЕФГЩЗжгыБћЭЌбЇЕФВТЯывЛжТЁЃРэгЩЪЧ_______ЁЃ
ЃЈЪЕбщНсТлЃЉЬњКЭЫЎеєЦјЗДгІЕФЛЏбЇЪНБэДяЪНЮЊ_______