题目内容
【题目】根据表中内容回答下列问题。
| 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(1)将接近饱和的澄清石灰水变为饱和,除增加溶质的方法以外,还可以通过___、____达到。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是____。
(3)向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”、“不变”或“减小”)。
(4)20℃时,氯化钠饱和溶液中溶质的质量分数为____(结果保留至0.1%)。
【答案】恒温蒸发溶剂 升高温度 20℃-40℃ 减小 26.5%
【解析】
(1)分析图表中数据可知,氢氧化钙的溶解度随温度升高而降低,将接近饱和的澄清石灰水变为饱和,除增加溶质的方法以外,还可以通过恒温蒸发溶剂、升高温度达到。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是20℃-40℃。
(3)向20℃的氢氧化钙饱和溶液中加入少量生石灰,生石灰和水反应生成氢氧化钙,且反应放热,再冷却至20℃,此时溶液仍是饱和溶液,溶解度不变,溶剂的质量减少,溶质的质量比加入生石灰前溶液中溶质的质量减少。
(4)20℃时,氯化钠的溶解度是36.0g,氯化钠饱和溶液中溶质的质量分数为:![]() 。
。

 第1卷单元月考期中期末系列答案
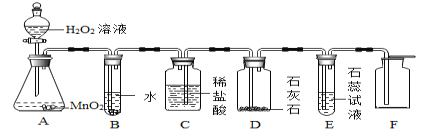
第1卷单元月考期中期末系列答案【题目】某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解快慢的因素。实验步骤及现象如下:
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的浓度 | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | t3 |
④ | 15 | 20 | 0.1 | t4 |
(1)对比①②两个实验,若t1>t2,则可得出的结论是:_____。
(2)能说明过氧化氢分解快慢与其浓度有关的实验是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?实验步骤及现象如下:
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入0.5g氧化铁粉末,并将带火星的木条分别伸入A、B两支试管中,观察现象。 | A试管中产生大量气泡,带火星的木条复燃;_____ |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把火星的木条伸入试管中,观察现象。 | 试管中产生大量气泡,带火星的木条复燃; |
Ⅲ.待实验Ⅱ中没有现象时,将试管中的反应剩余物过滤,并将滤渣洗涤、干燥、称量。 | 所得固体质量为_____g; |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入0.5g氧化铁粉末,向D试管中加入0.5g二氧化锰粉末,观察现象。 | —— |
(1)补充完成上述实验探究中表格的实验现象:①_____。②_____g。
(2)继续完成以下问题:
(实验结论)
①实验II、III证明_____。综上所述:氧化铁可以作过氧化氢分解的催化剂。
②写出氧化铁催化过氧化氢分解的符号表达式_____。
(实验评价)
③实验设计IV的目的是_____;
(实验拓展)
④查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A 二氧化锰只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质也可能是其他反应的反应物或生成物
【题目】为测定某黄铜(Cu﹣Zn合金)样品中锌的质量分数,某学习小组进行了如下实验:取20g黄铜样品,将其放在烧杯中,然后把80g稀硫酸分四次加入烧杯中,其反应的情况如下表所示:
步骤 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
剩余黄铜样品的质量/g | 17.4 | 14.8 | m | 13.2 |
(1)表中的m的值为___。
(2)此黄铜样品中锌的质量分数为___。
(3)所用稀硫酸溶质的质量分数是____(写出计算过程)。
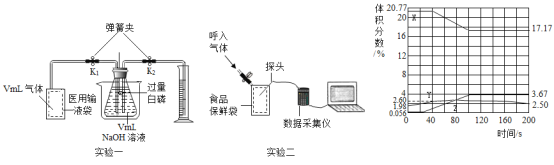
【题目】化学兴趣小组从一食品袋中获得一包脱氧剂,发现该脱氧剂为灰黑色粉末,若在空气中放置一段时间,有红棕色固体生成,研究后知:这是由于铁与空气中的_______和_______反应生成了铁锈。由此兴趣小组的同学对铁的性质产生了浓厚的兴趣,进行了一系列探究活动。
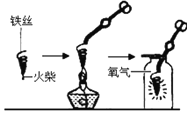
(探究一)铁丝燃烧程度与氧气浓度的关系。
(实验内容)取直径为![]() 铁丝,分别在体积分数
铁丝,分别在体积分数![]() 、
、![]() 、
、![]() 、
、![]() 的O2中实验。
的O2中实验。
实验现象:
|
|
|
|
|
实验现象 | 燃烧剧烈,效果好 | 燃烧比 | 燃烧比 | 难以燃烧, 只是发红 |
(结论)就直径为![]() 铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______
铁丝而言,燃烧所需氧气的最低体积分数为_______,且氧气浓度越大,燃烧现象越_______![]() 填“剧烈”或“不剧烈”
填“剧烈”或“不剧烈”![]() 。
。
(探究二)铁丝燃烧产生火星四射现象的原因
(1)图中螺旋状铁丝的末端系一根火柴的作用是_______;
(3)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。如表记录了他将纯铁丝和不同含碳量的铁丝![]() 铁丝直径为
铁丝直径为![]() 放入氧气中燃烧时的实验现象。请你分析完成如表:
放入氧气中燃烧时的实验现象。请你分析完成如表:
物质 | 纯铁丝 | 含碳 | 含碳 | 含碳 |
燃烧时 的现象 | 无火星四射现象, 熔断 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | _______ |
通过以上实验,说明铁丝燃烧产生火星四射现象和_______![]() 填元素符号
填元素符号![]() 含量多少有关。
含量多少有关。
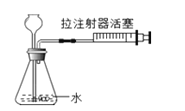
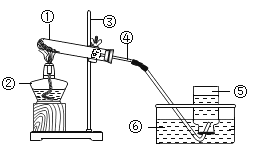
(探究三)铁粉与水蒸气反应后的产物
在常温下,铁与水几乎不反应。但在高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。乙同学设计了如图所示的实验进行探究。
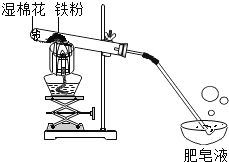
(1)试管尾部放一团湿棉花的目的是_______。
(2)探究生成的气体是什么?
待气体纯净后点燃,观察到管口有淡蓝色火焰,将干燥的冷烧杯倒罩在火焰上方,烧杯内壁出现水雾。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | Fe粉 | FeO |
|
|
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
能否溶于稀盐酸 | 能溶、冒气泡 | 能溶、无气泡 | 能容、无气泡 | 能溶、无气泡 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想1:剩余固体是![]() ;猜想2:剩余固体是_______。
;猜想2:剩余固体是_______。
(实验探究)丙同学取样品于试管中,滴加稀盐酸,发现固体全部溶解,有气泡冒出,丙同学认为猜想_______正确。
(实验证实)丁同学取样品![]() ,实验检验出其中含铁元素
,实验检验出其中含铁元素![]() ,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
,进一步证实了上述剩余固体的成分与丙同学的猜想一致。理由是_______。
(实验结论)铁和水蒸气反应的化学式表达式为_______