题目内容
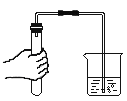
【题目】学习金属的化学性质时,老师给同学们做了锌与稀硫酸反应制取氢气的实验。有同学问老师:可以用锌与浓硫酸反应来制取氢气吗?老师让同学们先去查资料,然后对锌与浓硫酸反应产生的气体进行探究
(提出问题)锌与浓硫酸完全反应产生的气体是什么?
(查阅资料)
(1)浓硫酸是强氧化性酸,能与多数金属(如Mg、Zn、Cu等)反应产生SO2。
锌与浓硫酸反应:![]()
(2)SO2是一种有刺激性气味的有毒气体,与CO2有相似的化学性质,与Ca(OH)2反应产生不溶于水的CaSO3(提出猜想)猜想1:只有SO2 猜想2:H2和SO2 猜想3:_____。
(实验探究)
同学们在老师指导下设计并进行如下图的实验:
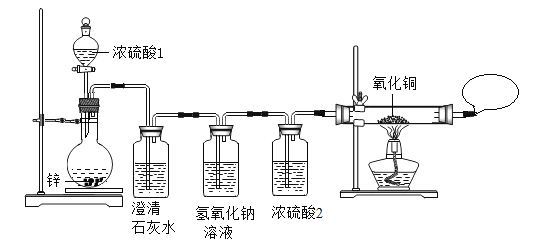
(现象与结论)
实验现象 | 实验结论 |
(1)_____。 | 有SO2产生。 |
(2)黑色的氧化铜变红色 | _____。 |
(得出结论)猜想_____正确。
(反思与拓展)
(1)实验中两处用了浓硫酸。浓硫酸2的作用是_____。
(2)有同学提出:实验进行到后阶段才能观察到黑色的氧化铜逐渐变红色。请解释实验开始阶段CuO处没有明显现象的原因:_____。
(3)实验室用金属与浓硫酸反应制取较纯的SO2气体,现有金属Zn和Cu最好选用金属_____理由是_____。
【答案】只有H2 澄清石灰水变浑浊(或有石灰水中有白色沉淀) 有H2产生 猜想2正确 吸水(干燥) 开始时是浓硫酸产生SO2,随着反应的进行硫酸变稀了,锌与稀硫酸反应才产生H2 Cu 铜与稀硫酸不反应,产生的气体中不会带进H2杂质
【解析】
[提出猜想]据质量守恒定律可知,反应前后元素的种类不变,锌和浓硫酸反应生成的气体可能是二氧化硫,也可能是锌和稀硫酸反应生成的氢气。猜想1:只有SO2 猜想2:H2和SO2 猜想3:H2;
[现象与结论]
(1)SO2与CO2有相似的化学性质,与Ca(OH)2反应产生不溶于水的CaSO3,如果观察到澄清石灰水变浑浊,则说明有SO2产生;
(2)氢气有还原性,能和氧化铜在加热条件下反应生成铜和水,如观察到黑色的氧化铜变红色,说明有氢气;
[得出结论]猜想2正确;
[反思与拓展]
(1)实验中两处用了浓硫酸。浓硫酸2的作用是干燥锌和硫酸反应产生的气体;
(2)有同学提出:实验进行到后阶段才能观察到黑色的氧化铜逐渐变红色。实验开始阶段CuO处没有明显现象的原因:开始时是浓硫酸反应产生SO2,随着反应的进行硫酸变稀了,锌与稀硫酸反应才产生H2 ,才能将氧化铜还原成红色的铜;
(3)浓硫酸是强氧化性酸,能与多数金属(如Mg、Zn、Cu等)反应产生SO2。实验室用金属与浓硫酸反应制取较纯的SO2气体,现有金属Zn和Cu最好选用金属铜,理由是铜与稀硫酸不反应,产生的气体中不会带进H2杂质。

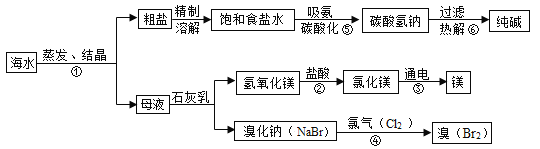
【题目】海水是巨大的资源宝库,如下图所示利用海水为原料可获得许多化工产品,下表为部分物质的溶解度,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.70 | |
NH4Cl | 33.2 | 37.21 | 41.4 | 45.8 |
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是____________。
(2)步骤②发生反应的化学方程式是________,其基本反应类型为____________;步骤③中是电能转化为__________能。
(3)步骤④是向溴化钠中通入氯气,生成溴单质和一种盐,发生的是置换反应,试写出该反应的化学方程式______________。
(4)步骤⑤中碳酸氢钠先结晶析出,原因是____________;进行生产时,先向饱和食盐水中通入氨气,再加压不断通人二氧化碳气体,其理由是____________。
(5)写出步骤⑥的化学方程式__________________。
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是________。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
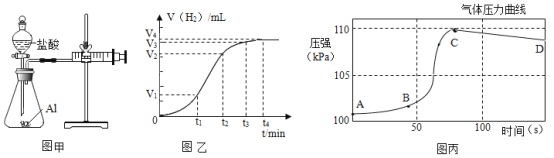
(设计并实验)小明利用图甲所示装置,用不同浓度的盐酸和相同形状的铝片进行如下实验。
(交流讨论)(1)请写出铝与酸反应的化学方程式:____________。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是__________。
(分析数据、得出结论)(3)实验中记录的数据可能是:__________;对比实验②③可知_________对金属与酸反应的速率的影响
(4)实验表明,四次实验时反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸浓度为10%,温度为25℃,则所记录数据应该介于_____________两次实验所记录的数据之间。
(拓展延伸)(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:___________。
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入图片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。CD段气体压力逐渐下降的原因是:___________。