题目内容
【题目】中国在南海海域实现可燃冰试采成功,其主要成分的化学式为CH4nH2O,这标志着我国可燃冰开采技术已居世界前列。

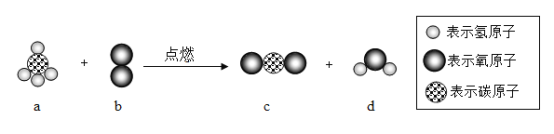
(1)如图甲所示,可燃冰中的水分子形成一种笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,由此可知可燃冰属于_____(选填“纯净物”或“混合物”)
(2)若某种可燃冰中CH4与H2O的质量比是1:9,则该可燃冰中n=_____。
(3)图乙表示甲烷在催化剂作用下合成某化工原料的微观示意图。试写出该反应的化学方程式(提示:有机物化学式一般按照C、H顺序来书写):_____。
【答案】混合物 8 2CH4 C2H4+2H2
C2H4+2H2
【解析】
本题是对可燃冰结构和性质的研究。
(1)可燃冰中的水分子形成一种笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,由此可知可燃冰属于混合物。
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得可燃冰分子中CH4与H2O的质量比为:(12+1×4):n(1×2+16)=1:9;则n=8。
(3)由微观反应示意图可知,甲烷在催化剂的作用下生成C2H4和氢气,该化学反应的方程式为:2CH4 C2H4+2H2。
C2H4+2H2。

【题目】学习金属的化学性质时,老师给同学们做了锌与稀硫酸反应制取氢气的实验。有同学问老师:可以用锌与浓硫酸反应来制取氢气吗?老师让同学们先去查资料,然后对锌与浓硫酸反应产生的气体进行探究
(提出问题)锌与浓硫酸完全反应产生的气体是什么?
(查阅资料)
(1)浓硫酸是强氧化性酸,能与多数金属(如Mg、Zn、Cu等)反应产生SO2。
锌与浓硫酸反应:![]()
(2)SO2是一种有刺激性气味的有毒气体,与CO2有相似的化学性质,与Ca(OH)2反应产生不溶于水的CaSO3(提出猜想)猜想1:只有SO2 猜想2:H2和SO2 猜想3:_____。
(实验探究)
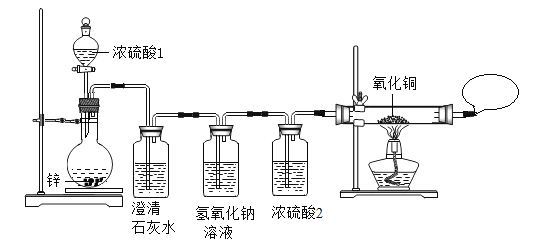
同学们在老师指导下设计并进行如下图的实验:
(现象与结论)
实验现象 | 实验结论 |
(1)_____。 | 有SO2产生。 |
(2)黑色的氧化铜变红色 | _____。 |
(得出结论)猜想_____正确。
(反思与拓展)
(1)实验中两处用了浓硫酸。浓硫酸2的作用是_____。
(2)有同学提出:实验进行到后阶段才能观察到黑色的氧化铜逐渐变红色。请解释实验开始阶段CuO处没有明显现象的原因:_____。
(3)实验室用金属与浓硫酸反应制取较纯的SO2气体,现有金属Zn和Cu最好选用金属_____理由是_____。