题目内容
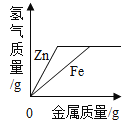
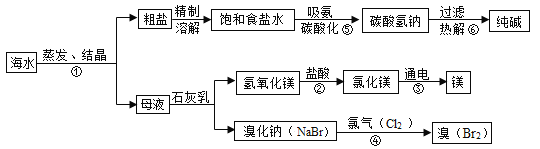
【题目】海水是巨大的资源宝库,如下图所示利用海水为原料可获得许多化工产品,下表为部分物质的溶解度,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.70 | |
NH4Cl | 33.2 | 37.21 | 41.4 | 45.8 |
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是____________。
(2)步骤②发生反应的化学方程式是________,其基本反应类型为____________;步骤③中是电能转化为__________能。
(3)步骤④是向溴化钠中通入氯气,生成溴单质和一种盐,发生的是置换反应,试写出该反应的化学方程式______________。
(4)步骤⑤中碳酸氢钠先结晶析出,原因是____________;进行生产时,先向饱和食盐水中通入氨气,再加压不断通人二氧化碳气体,其理由是____________。
(5)写出步骤⑥的化学方程式__________________。
【答案】食盐的溶解度随温度的升高而变化不明显 2HCl+Mg(OH)2=MgCl2+2H2O 复分解反应 化学 2NaBr+Cl2=Br2+2NaCl 在相同的温度下,碳酸氢钠的溶解度比氯化铵小 饱和氨盐水显碱性,有利于吸收二氧化碳 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
(1)步骤①中采用蒸发结晶法而不是降温结晶法,是因为食盐的溶解度随温度的升高而变化不明显
(2)步骤②是盐酸和氢氧化镁反应生成氯化镁和水,2HCl+Mg(OH)2=MgCl2+2H2O。该反应属于复分解反应。步骤③中是电能转化为化学能。
(3)溴化钠中通入氯气,生成溴单质和一种盐,该盐应该是氯化钠,反应的方程式为: 2NaBr+Cl2=Br2+2NaCl。
(4)由表可知,在相同的温度下,碳酸氢钠的溶解度比氯化铵小,故碳酸氢钠先析出。在用氨碱法生产纯碱过程中,先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通过二氧化碳,其原因是饱和氨盐水显碱性,有利于吸收二氧化碳.
(5)碳酸氢钠在加热的条件下反应生成碳酸钠、水和二氧化碳,反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】学习金属的化学性质时,老师给同学们做了锌与稀硫酸反应制取氢气的实验。有同学问老师:可以用锌与浓硫酸反应来制取氢气吗?老师让同学们先去查资料,然后对锌与浓硫酸反应产生的气体进行探究
(提出问题)锌与浓硫酸完全反应产生的气体是什么?
(查阅资料)
(1)浓硫酸是强氧化性酸,能与多数金属(如Mg、Zn、Cu等)反应产生SO2。
锌与浓硫酸反应:![]()
(2)SO2是一种有刺激性气味的有毒气体,与CO2有相似的化学性质,与Ca(OH)2反应产生不溶于水的CaSO3(提出猜想)猜想1:只有SO2 猜想2:H2和SO2 猜想3:_____。
(实验探究)
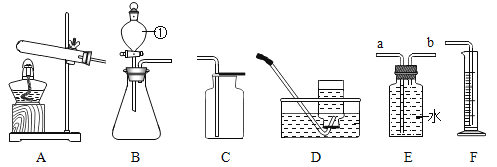
同学们在老师指导下设计并进行如下图的实验:
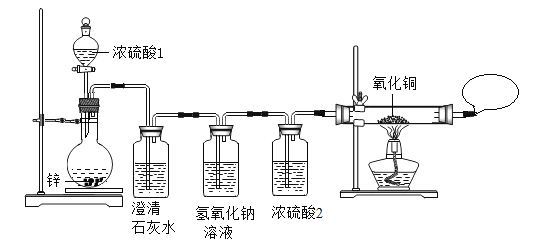
(现象与结论)
实验现象 | 实验结论 |
(1)_____。 | 有SO2产生。 |
(2)黑色的氧化铜变红色 | _____。 |
(得出结论)猜想_____正确。
(反思与拓展)
(1)实验中两处用了浓硫酸。浓硫酸2的作用是_____。
(2)有同学提出:实验进行到后阶段才能观察到黑色的氧化铜逐渐变红色。请解释实验开始阶段CuO处没有明显现象的原因:_____。
(3)实验室用金属与浓硫酸反应制取较纯的SO2气体,现有金属Zn和Cu最好选用金属_____理由是_____。