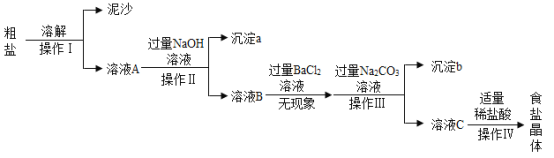
题目内容
【题目】某化学兴趣小组通过探究活动学习和理解化学知识。请你一起研究学习,并回答有关问题。
研究问题:水溶液中复分解反应的微观实质
相关信息:
(Ⅰ)电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
(Ⅱ)相同温度下同种溶液电导率越大,离子浓度越大。
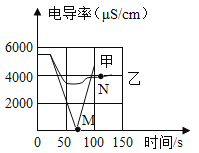
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
①写出Ba(OH)2与H2SO4反应的化学方程式____________。
②M点时电导率为零,离子浓度也几乎为零,此时混合液体静置后呈____________色;
③通过对甲曲线的分析,下列说法错误的是____________(填序号)。
A.M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示。
①通过对乙曲线的分析,下列说法正确的是____________(填序号)。
A.实际参加反应的是Ba2+和SO42-结合成了BaSO4,Na+和OH-还是以离子形式存在于溶液中
B.溶液红色只会变浅,但不会褪去
②N点时,溶液中大量含有的离子是___________(填离子符号)。
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度____________(填“增大”或“减小”)。
(3)拓展:
①请根据示例仿写离子方程式。
示例![]() 离子方程式:
离子方程式: ![]()
仿写: ![]() 离子方程式:____________________。
离子方程式:____________________。
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失。请推测此过程的溶液中Ca2+的浓度变化情况_________________。
【答案】![]() 无 B AB Na+、OH-、SO42- 减少
无 B AB Na+、OH-、SO42- 减少 ![]() 先变小后变大
先变小后变大
【解析】
(1)①氢氧化钡与硫酸反应生成硫酸钡沉淀和水,该反应的化学方程式为:![]() ;
;
②M点时,氢氧化钡与硫酸恰好完全反应,生成硫酸钡沉淀和水,水呈中性,不能使无色酚酞试液变红,故此时混合液体静置后呈无色;
③A、M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4,说法正确,不符合题意;
B、M点后溶液电导率逐渐增大,不仅由于溶液中H+在逐渐增大,而且SO42-也在增大,说法错误,符合题意。故选B。
(2)①A、实际参加反应的是Ba2+和SO42-结合成了BaSO4,Na+和OH-还是以离子形式存在于溶液中,说法正确,符合题意;
B、溶液中含有氢氧根离子,能使无色酚酞试液变红,随着硫酸钠的加入,氢氧根离子的浓度变小,溶液的碱性减弱,溶液颜色会变浅,但是不会褪去,符合题意。故选AB。
②氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,N点时,硫酸钠过量,故溶液中含有的离子是Na+、OH-、SO42-;
③复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,溶质质量减小,导致其浓度减小;
(3)①![]() 的离子方程式为:
的离子方程式为:![]() ;
;
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,氢氧化钙和二氧化碳反应生成碳酸钙和水,钙离子浓度逐渐变小,后碳酸钙与二氧化碳、水反应又生成了可溶性的碳酸氢钙,钙离子浓度又逐渐变大,故溶液先变浑浊后浑浊逐渐消失的过程中,溶液中Ca2+的浓度变化情况:先变小,后变大。

【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)原混合物中碳酸钙与氯化钙的质量比为_____________;
(2)求表中m的值____________ (要求写出完整的过程)。
【题目】牙膏是一种日用必需品。某兴趣小组对某一品牌牙膏中所含摩擦剂的成分进行了如下探究。
[查阅资料]
(1)常用的牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2。
(2)牙膏中除了碳酸钙以外,其他物质均不与稀盐酸反应产生气体。
(3)SiO2不溶于水,也不与盐酸反应。氢氧化铝和稀盐酸可以发生中和反应。
(4)AI(OH)3能和氢氧化钠溶液发生反应,该反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2_____(填化学式)
[提出问题]:该品牌牙膏的酸碱性如何?其中含有什么摩擦剂?
[实验与猜想]
(1)取少量牙膏膏体于小烧杯中,加入10毫升蒸馏水,充分搅拌,静置一段时间,分离上层清液和沉淀;
(2)用____(填字母)测定所得溶液的pH值大于7。
A pH试纸
B 紫色石蕊试液
C 酚酞试液
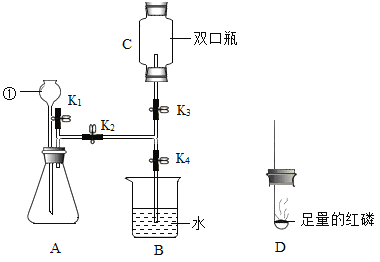
(3)取少量沉淀物加入过量的稀盐酸,沉淀物全部溶解并有大量气泡产生,同时得到澄清溶液,如图所示,则该品牌牙膏中一定含有碳酸钙,一定不含有_____。
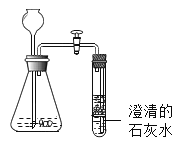
(4)进行猜想:摩擦剂成分可能是a.只含碳酸钙b._____。
[设计实验]同学们为进一步 确认摩擦剂中含有氢氧化铝,进行了如下实验:
实验步骤 | 实验现象 | 解释与结论 |
取实验(3)中锥形瓶内反应后的澄清溶液,逐滴滴入定量氢氧化钠溶液 | 开始无明显现象,后产生大量白色沉淀 | 开始无明显现象,是因为开始时加入的氢氧化钠溶液和过量的____反应。继续滴入氢氧化钠化钠溶液后产生白色沉淀原因是_____(用化学方程式表示) |
继续滴入氢氧化钠溶液至过量 | 白色沉淀溶解 | 摩擦剂中还含有氢氧化铝 |
[实验结论]该牙膏摩擦剂成分可以确定。
[总结与提升]判断混合物中物质成分时,除了要考虑生成物,还要考虑_____。
【题目】某同学为探究纯金属及其合金性质,进行了如下实验。
0-1小时 | 1 小时-2小时 | 2小时-3小时 | |
5%的稀硫酸 | 无气泡产生 | ||
15%的稀硫酸 | 无气泡 | 少量小气泡,反应缓慢 | 少量小气泡增加不明显,缓慢 |
表:黄铜片与不同浓度的稀硫酸
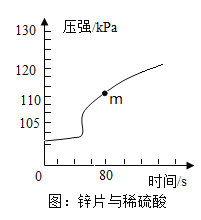
(1)取锌片于密闭容器中,加入足量5%的稀硫酸,反应时气体压强的变化曲线如图。开始时容器内气体压强几乎不变,共原因是_____________。 m点时,所得溶液中除水之外还含有的物质有______________。
(2)另取两片相同的黄铜(铜锌合金,含锌量与实验1相同),分别放入足量不同浓度的稀硫酸中,观察记录实验现象如表。分析可知,制成合金的一个目的是_____________。
(3)某工厂废液池中溶液的主要成分是硫酸锌、硫酸铜和硫酸,生产过程中还回收了一些锌粉。若只利用废液和锌粉制铜,请设计实验方案_____________。