题目内容
【题目】蛋白质是由丙氨酸(C3H7NO2) 等多种氨基酸构成。根据丙氨酸的化学式计算:
(1) C3H7NO2 的相对分子质量是_____。
(2)丙氨酸中各元素的质量比C: H: N: O=_____。
(3)丙氨酸中氮元素的质量分数为_____(计算结果保留到0.1%)。
【答案】89 36:7:14:32 15.7%
【解析】
(1)丙氨酸的相对分子质量为12×3+1×7+14+16×2=89,故填:89;
(2)丙氨酸中C、H、N、O元素的质量比为:(12×3):(7×1):14:(16×2)=36:7:14:32;故填:36:7:14:32;
(3)根据氮元素的质量分数公式,则丙氨酸中氮元素的质量分数=![]() ×100%≈15.7%;故填:15.7%。
×100%≈15.7%;故填:15.7%。

【题目】含氮化合物是重要的化工原料。
(1)氨气是由_____(填“分子”、“原子”或“离子”)构成的。
(2)氨气溶于水显碱性,是因为氨气与水反应生成了碱,请写出这种碱的化学式_____。
(3)NH4NO3 是一种重要的氮肥,请标出 NH4NO3中氮元素的化合价_____。已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数 为_____。
(4)请完成鉴别氯化铵和硝酸铵两种溶液的实验报告。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
【题目】铝作为金属材料在近200多年的历史中被广泛应用。根据下列资料回答:
物质的相关信息 | 铜 | 铝 |
密度(g/cm3) | 8.92 | 2.70 |
地壳中含量(质量分数/%) | 0.007 | 7.73 |
导电性(以银的导电性为100作标准) | 99 | 61 |
(1)铝的导电性比铜小,为什么高压电线常用铝制_____?
(2)用铝制高压电线时外面不需要包绝缘体,用化学方程式表示原因_____。
(3)飞机外壳用硬铝制而不用铝制的原因_____。
【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④
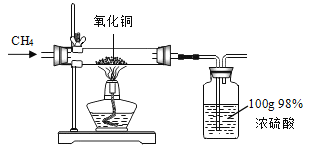
【题目】碳还原氧化铜的实验如图1所示。写出该反应的化学方程式:________。
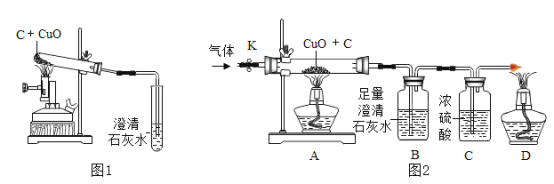
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO。猜想②:CO2。猜想③:________。
[设计方案]实验装置如图2(浓硫酸具有吸水作用)。打开K,缓缓通人干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)实验时A处的现象是_______。
(2)若B中无明显实验现象,D处气体能被点燃,则猜想______(填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B +C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4-m3)______(填“<”“=”或“>”)(m1-m2)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是_____。
[交流反思]实验开始前缓缓通入氮气的目的是_______。