题目内容
【题目】2019年是国际元素周期表年。俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质量约为68的元素的存在,且性质与铝相似,称为“类铝”。如图是元素周期表中“类铝”元素镓的相关信息,回答下列问题:
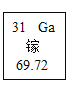
(1)镓原子核外电子数为_____。
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式为_____。可推测镓在金属活动性顺序里位于_____ (填“氢前”“氢后”)。
(3)高纯氧化镓广泛用于生产半导体材料,制高纯氧化镓的第一步是向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga (NH4) (SO4)2固体。Ga (NH4)(SO4)2中含有的带正电荷的原子团(根)是_____。
【答案】31 ![]() 氢前 NH4+(或铵根)
氢前 NH4+(或铵根)
【解析】
(1)根据元素周期表中的一格可知,左上角的数字为31,表示原子序数为31;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为31。故填:31;
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是:2Ga+3H2SO4═Ga2(SO4)3+3H2↑,可推测镓在金属活动性顺序里位于氢前面。故填:2Ga+3H2SO4═Ga2(SO4)3+3H2↑;氢前;
(3)Ga(NH4)(SO4)2中含有的带电的原子团是铵根和硫酸根,其符号是NH4+、SO42-,其中NH4+是带正电的原子团。故填:NH4+(或铵根)。

【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④